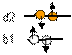Пятимерная сортировка атомов
Двумерная сортировка атомов была предложена Д.И.Менделеевым. Первое измерение - сортировка атомов по количеству протонов в ядре. Второе измерение – сортировка по периодически изменяющимся химическим свойствам. Химическим элементом будем называть всю совокупность атомов с одинаковым количеством протонов в ядре. Менделеев обнаружил периодичность в изменении химических свойств химических элементов при возрастании атомного веса, благодаря чему все химические элементы удалось расположить в виде таблицы, его именем и названной. Каждый химический элемент имеет собственное название и буквенное международное обозначение. Кроме того, в ячейке таблицы указывается количество протонов в ядре и среднестатистический вес атома химического элемента в атомных единицах массы. Химические элементы, расположенные в одном столбце таблицы имеют идентичные химические свойства.
|
3 Li литий |
4 Be бериллий |
5 B бор |
6 С углерод |
7 N азот |
8 O кислород |
9 F фтор |
10 Ne |
|
11 Na натрий |
12 Mg магний |
13 Al алюминий |
14 Si кремний |
15 P фосфор |
16 S сера |
17 Cl хлор |
18 Ar |
Рисунок 1. Часть таблицы Менделеева
Более точные эксперименты показали, что при одном и том же количестве протонов в ядре атома может находиться разное количество нейтронов. Таким образом, в настоящее время существует третье измерение, в котором каждый химический элемент в таблице Менделеева расщепляется на изотопы. Изотопом будем называть всю совокупность атомов с одинаковым количеством протонов и нейтронов в ядре. Для идентификации изотопов используется буквенное обозначение химического элемента в совокупности с цифровым обозначением общего количества нуклонов (протонов и нейтронов) в ядре. Все изотопы принято располагать в виде двумерной таблицы, в которой одним измерением является количество протонов в ядре, а другим измерением является количество нейтронов в ядре. Стабильные изотопы, в данной таблице, группируются в виде длинного узкого островка, окруженного со всех сторон нестабильными изотопами. Островок стабильности принято называть долиной стабильности. Изотопы одного химического элемента можно отделять друг от друга физическими методами (центрифугами, например).
|
8(O) |
O 12 |
O 13 |
O 14 |
O 15 |
O 16 |
||||
|
7(N) |
N 10? |
N 11 |
N 12 |
N 13 |
N 14 |
N 15 |
|||
|
6(C) |
C 8 |
C 9 |
C 10 |
C 11 |
C 12 |
C 13 |
C 14 |
||
|
5(B) |
B 7 |
B 8 |
B 9 |
B 10 |
B 11 |
B 12 |
B 13 |
||
|
4(Be) |
Be5 |
Be6 |
Be7 |
Be8 |
Be9 |
Be10 |
Be11 |
Be12 |
|
|
3(Li) |
Li3? |
Li4 |
Li5 |
Li6 |
Li7 |
Li8 |
Li9 |
Li10 |
Li11 |
|
2(He) |
He3 |
He4 |
He5 |
He6 |
He7 |
He8 |
He9 |
He10? |
|
|
1(H) |
H1 |
H2 |
H3 |
H 4 |
H 5 |
H 6 |
|||
|
0 |
n 1 |
n 2? |
n 3? |
n 4? |
n5? |
n 6? |
|||
|
p/n |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Рисунок 2. Часть таблицы изотопов
Трехмерная сортировка атомов является неполной, так как не хватает данных для объяснения таких свойств некоторых атомов, как переменная валентность или появление химической активности только после возбуждения атома (нагрев, встряска, воздействие катализатора, возбуждение звуковыми или электромагнитными волнами). Нужна еще дополнительная сортировка, которая помогла бы объяснить такие свойства атомов. Согласно экспериментальным данным, ядро атома может находиться в разных энергетических состояниях, отличающихся друг от друга значением спина и четностью. То есть, реально существует еще одно измерение – четвертое, в котором возбужденные изотопы расщепляются на изоспины - атомы с одинаковым спином ядра и одинаковой четностью ядра. Такая сортировка уже позволяет осознать, что атомы даже одного и того же изотопа могут обладать разными физическими свойствами.
|
He |
|||||
|
1+ |
He4.1+ |
|
|
|
|
|
1- |
He4.1- |
|
He6.1- |
|
He8.1- |
|
3/2+ |
|
He5.3/2+ |
|
|
|
|
3/2- |
|
He5.3/2- |
|
He7.3/2- |
|
|
2+ |
He4.2+ |
|
He6.2+ |
|
He8.2+ |
|
2- |
He4.2- |
|
He6.2- |
|
|
|
Jπ/n |
2 |
3 |
4 |
5 |
6 |
Рисунок 3. Часть таблицы изоспинов гелия
Итак, атомный изоспин - это совокупность атомов одного изотопа с одинаковым значением спина и четности. Разделить изоспины друг от друга можно физическими методами, но в ряде случаев такое разделение не имеет смысла, так как нахождение ядра атома в каком-либо возбужденном состоянии может быть недолгим. В любое время, из-за внешних воздействий, оно может перейти в другое энергетическое состояние. Новое измерение позволяет для каждого химического элемента из таблицы Менделеева, минуя таблицу изотопов, создать двумерную таблицу, ячейки которой заполняются обозначениями изоспинов с экспериментально полученными значениями спина и четности. Одним измерением таблицы будет количество нейтронов в ядре химического элемента, а другим измерением – значение спина и четности. Для идентификации изоспинов будем использовать обозначение изотопа, разделенное точкой с цифровым обозначением спина и четности.
|
He4 |
He4.0+ |
He4.0- |
|
|
He4.2+ |
He4.2- |
|
|
№\ Jπ |
0+ |
0- |
P-отражение |
|
|
2+ |
2- |
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
Рисунок 4. Часть таблицы изомеров ядер для изотопа гелия He4
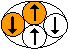
Механистическая модель строения ядер атомов позволяет вернуть спину и четности первоначальный механический смысл. По определению, ядра с отрицательной четностью имеют зеркальные отражения, при которых каждая координата нуклона меняет знак, но направление спин нуклона не меняется. Такое зеркальное отражение называется P-отражением. Отраженные ядра похожи внешне, имеют одинаковый по абсолютной величине спин, но направление спина противоположное при одинаковой ориентации ядер в пространстве. Таким образом, очевидно, что появляется пятое измерение, в котором изотопы с одинаковым значением спина расщепляются на изомеры. Атомным изомером будем называть группу атомов одного изотопа с равным значением спина и четности ядра и одинаковой пространственной конфигурацией ядра. P-отражение не является единственной причиной расщепления на изомеры. Спин и четность может совпадать даже при пространственной конфигурации ядер, внешне совершенно не похожих. Новое измерение позволяет для каждого изотопа из таблицы изотопов, минуя таблицу изоспинов, создать двумерную таблицу, ячейки которой заполняются графическими изображениями пространственной конфигурации ядра. Одним измерением таблицы будет значение спина и четности, а другим - порядковый номер изомера. Только теперь, имея перед глазами такую таблицу, становится понятными причины переменной валентности химического элемента и причины появления химической активности только после возбуждения атома при нагреве, встряске, воздействии катализатора, при возбуждении звуковыми или электромагнитными волнами. По графическому изображению ядра можно вычислить не только его физические характеристики (спин, четность, энергия связи и пр.), но и валентность атома. В зависимости от конфигурации ядра, атомы с одинаковым количеством протонов и нейтронов могут иметь разную валентность. Если все протоны в ядре находятся в полностью заполненных ядерных оболочках, то атом инертен, химически пассивный. Если хотя бы один протон находится в незавершенной ядерной оболочке, то атом химически активен и может вступать в химическую реакцию. Завершенная оболочка протонов формируется вокруг завершенной нейтронной оболочки с таким же количеством нейтронов. Завершенными нейтронными оболочками являются кольца из четного количества нейтронов с чередующимся направлением спина. Количество нейтронов в малых кольцах – 4 или 6. Вокруг малых колец могут формироваться кольца побольше – 10, 16, 22 нейтрона вокруг кольца из 4 нейтронов или 12, 18 нейтронов вокруг кольца из 6 нейтронов. Соответственно, полностью заполненные протонные оболочки могут иметь 4, 6, 10, 12, 16, 18, 22 протона. Единственным исключением является полностью заполненная оболочка из двух протонов. Она формируется не вокруг кольца, а вокруг нейтронной оси из одного или двух нейтронов.
. Владимир Яковлев, lun1@list.ru , http://logicphysic.narod.ru , январь 2008 года