Вихревые модели атомов лития
По официальным представлениям, нельзя одновременно определить координату и скорость частицы – протона, нейтрона или электрона. Считается, что нуклоны движутся, но определить пространственное распределение протонов и нейтронов в ядре нельзя. Исходя из таких представлений, атом лития изображается следующим образом: в центре атома находится ядро в виде компактной бесформенной кучки нуклонов с хаотическим распределением протонов и нейтронов. Вокруг ядра, независимо от пространственного распределения протонов, хаотически вращаются три электрона. Два электрона принадлежат одному полностью заполненному внутреннему s-слою, третий электрон принадлежит внешнему s-слою. Электронное облако каждого s-слоя имеет сферообразную форму. В химических реакциях участвует электрон внешнего s-слоя, наиболее удаленный от ядра.
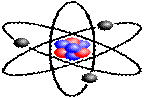
Рисунок 1. Официальное представление об атоме лития
Согласно же ядерной модели, созданной автором, траектории движения электронов в атоме жестко связаны с пространственным распределением протонов в ядре. Распределение протонов и нейтронов в ядре меняется под воздействием внешних возмущений, но большую часть времени ядро находится в наиболее стабильных состояниях, в которых кулоновское отталкивание протонов исключено либо экранированием нейтронами, либо особым взаиморасположением, при котором исключаются ситуации совпадения осей симметрии протонов. С точки зрения химических процессов интерес представляют только стабильные или долгоживущие изотопы. Из всех известных изотопов лития стабильными являются только Li6 и Li7. Количество всевозможных ядерных комбинаций этих изотопов несколько десятков, но количество вероятных конфигураций атомов гораздо меньше, потому что одна конфигурация атома соответствует нескольким ядерным комбинациям.
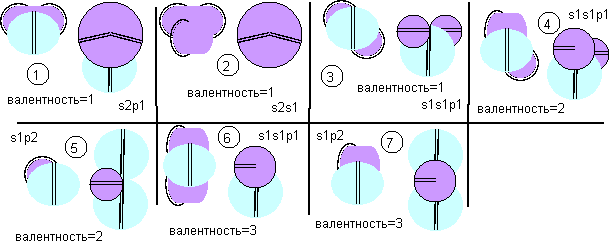
Рисунок 2. Наиболее вероятные конфигурации атома лития
Выше изображены семь всевозможных конфигураций атома лития с валентностью от 1 до 3. К схемам добавлены соответствующие атомам формулы из современного математического описания. Соответствующие этим атомам ядра изображены на рисунке ниже. Ядерные исследования выявили, что альфа-частицы обладают пиком энергии взаимодействия. Можно полагать, что наиболее стабильными конфигурациями атомов лития являются такие, в которых альфа-частица является составной частью ядра. Такими конфигурациями являются первая и вторая. Остальные же конфигурации, скорее всего, являются временными возбужденными состояниями. У первой и у второй конфигурации величина спина ядра соответствует экспериментальным данным и для Li6, и для Li7. Поэтому нельзя сходу по одному параметру определить какая конфигурация, из двух, соответствует основному состоянию атома. С логической точки зрения основным состоянием должна быть наиболее компактная форма – первая конфигурация. Первая конфигурация химически агрессивна и обладает положительной валентностью, а вторая конфигурация химически слабо активная и обладает нейтральной валентностью.
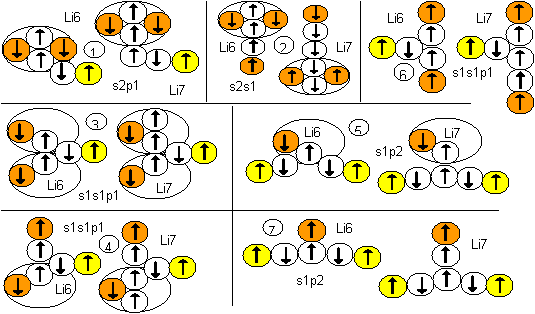
Рисунок 3. Ядра атомов лития
Рассмотрим образование молекул из атомов с нейтральной валентностью. В чистых парах лития могут образовываться молекулы лития. Если расположить атомы одинаково (осевым лепестком вверх), то можно условно поделить их на левые и правые. Слипаться между собой способны только атомы противоположного типа. Если количество левых и правых атомов разное, то в чистых парах лития кроме молекул лития всегда будут оставаться свободные атомы, которые не будут вступать в химическую реакцию друг с другом ни при каких условиях.

Рисунок 4. Молекула Li-Li с атомом лития второй конфигурации
Таким же образом правые атомы лития будут слипаться только с левыми атомами фтора, а правые атомы фтора могут слипаться только с левыми атомами лития. Такая молекула лития при потере кинетической энергии тоже способна образовывать вихревую нить, также как и атом гелия плоской конфигурации в фазе сверхтекучести.
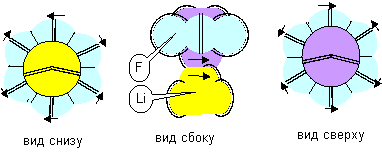
Рисунок 5. Молекула Li-F с атомом лития второй конфигурации
Простейшей молекулой будет гидрид лития, где атом водорода орбитальной модели слипается с осевым лепестком атома лития. Здесь атом водорода может слипаться и с правыми, и с левыми атомами лития, он только должен повернуться к атому фтора нужным полюсом.
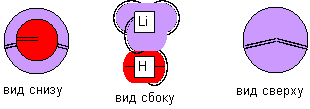
Рисунок 6. Молекула Li-H с атомом лития второй конфигурации
Хотя в литературе и нет данных о химических реакциях между литием и гелием, но теоретически возможно существование соединения лития с осевым атомом гелия. На смесь атомов гелия и паров лития нужно воздействовать либо сильным неоднородным магнитным полем, либо сильным электрическим разрядом, либо электромагнитным излучением, чтобы перевести атомы гелия в осевую форму. Возможность слипания с атомом лития будет зависеть только от ориентации в пространстве атома гелия.
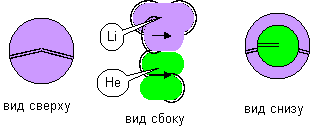
Рисунок 7. Молекула Li-He с атомом лития второй конфигурации
Первая конфигурация обладает очень интересной новой особенностью – в ее ядре экваториальная нуклонная пара может свободно поворачиваться вокруг нейтронной оси. В атоме гелия экваториальной конфигурации вокруг нейтронной оси протоны самостоятельно вращаются с постоянной скоростью без воздействия внешних сил. Во всех остальных рассмотренных ранее моделях атомов вокруг нейтронной оси вообще не способен вращаться ни один нуклон. А в данной модели атома целая нуклонная пара способна поворачиваться вокруг нейтронной оси, правда только под воздействием внешних сил. Примером может послужить удар свободно летящего нейтрона. После удара нуклонная пара повернется, а нейтрон отскочит и изменит направление движения. Атомы с такой конфигурацией могут находиться в двух состояниях с одинаковыми химическими свойствами, но с разными физическими свойствами, потому что электронный лепесток с возможностью вращения может быть прикреплен к одному из двух полюсов. Разницу можно физически определить по отношению к направлению спинов нейтронов нейтронной оси. Наиболее активно атомы такой конфигурации должны соединяться с атомами фтора. В молекуле фторида лития электронный лепесток лития становится частью атома фтора, поэтому связь атомов имеет максимальную полярность.
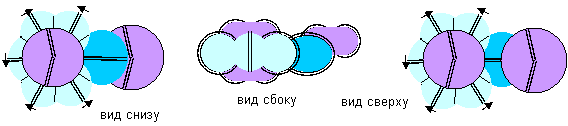
Рисунок 8. Молекула Li-F с атомом лития первой конфигурации
Взаимодействие атомов фтора и лития может начинаться уже на расстояниях, много больше размеров атомов. Присутствие вдали атома фтора нарушает баланс сил между электронным лепестком и ядром атома лития. Взаимодействие начинается с сильного вытягивания электронного лепестка атома лития, который стремится втянуться в лепестковую вакансию атома фтора. Затем, под действием кулоновских сил, начинают и атомы сближаться до наступления баланса сил. Электронный лепесток, при этом, сокращается.

Рисунок 9. Процесс взаимодействия атомов фтора и лития на дальних расстояниях
В случае, когда электронное облако по каким-либо причинам полностью вместе с электроном переходит в другой атом, то образуется ион лития, конфигурация которого совпадает с конфигурацией атома гелия экваториальной модели. Ион может образовываться и из атома лития путем внешнего воздействия на электрон. Так как наименее прочно с атомом связан экваториальный электрон, то он может покинуть атом при гораздо меньшей энергии ионизации.

Рисунок 10. Конфигурация иона лития
Слабовыраженной полярностью обладает молекула гидрида лития. Орбиты электронов в месте соприкосновения электронных облаков должны создавать общий поток.
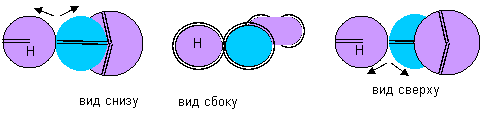
Рисунок 11. Молекула Li-H с атомом лития первой конфигурации
В молекуле лития обе связи полностью равноправны, поэтому никакой полярности нет совсем.

Рисунок 12. Молекула Li-Li из атомов лития первой конфигурации
Возбужденные состояния атома лития тоже имеют право на существование. Вероятность существования увеличивается, если атом в возбужденном состоянии успел стать частью молекулы. Химические соединения атома третьей конфигурации будут идентичны химическим соединениям с участием атома первой конфигурации. Будут отличаться только физические свойства, особенно в твердой фазе.
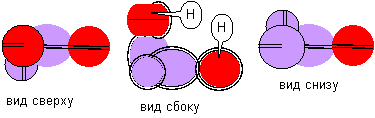
Рисунок 13. Молекула H-Li-H с атомом лития четвертой конфигурации
Следующие четыре конфигурации могут быть ядром экзотических молекул с двух и трех валентным литием. Все электронные лепестки одного цвета теперь будут одним цветом. А разные атомы будут отличаться цветом. Атом лития четвертой конфигурации станет ядром молекулы, в которой угол между направлениями на концевые атомы будет близок к 90 градусам.
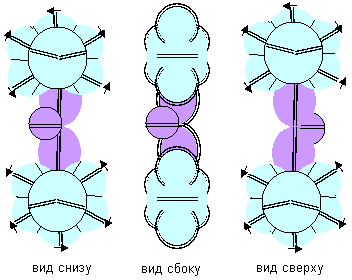
Рисунок 14. Молекула F-Li-F с атомом лития пятой конфигурации
Атом лития пятой конфигурации станет ядром молекулы, в которой угол между направлениями на концевые атомы будет близок к 180 градусам.
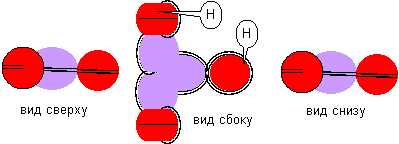
Рисунок 15. Молекула H-(H-Li-H) с атомом лития шестой конфигурации
Атом лития шестой конфигурации должен быть устойчивым в сильном магнитном поле.
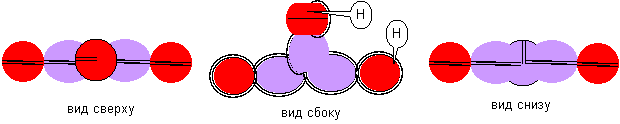
Рисунок 16. Молекула H-(H-Li-H) с атомом лития седьмой конфигурации
Атомы лития шестой и седьмой конфигурации станут ядрами молекул, в которых углы между направлениями на концевые атомы будут близки к 180 и 90 градусам.
Владимир Яковлев, lun1@list.ru , http://logicphysic.narod.ru , апрель 2010 года