Вихревые модели атомов бериллия
У бериллия только один изотоп Ве9 является стабильным. Рассмотрим несколько теоретически наиболее возможных конфигураций атомов этого изотопа. Каждая конфигурация сопровождается соответствующей формулой современного математического описания.
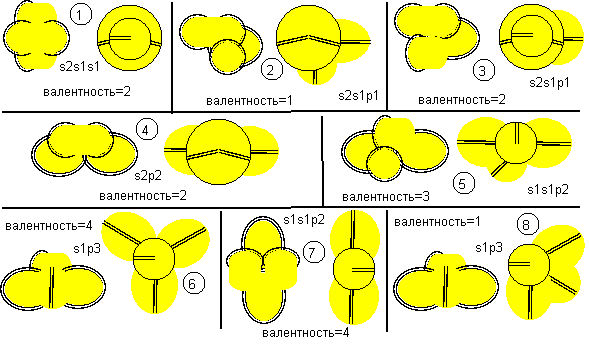
Рисунок 1. Наиболее вероятные конфигурации атома бериллия
Соответствующие этим атомам ядра изображены на рисунке ниже. Овалом обведены протоны, вращающиеся вокруг нейтронной оси.
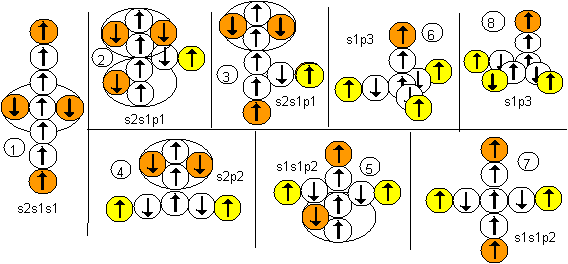
Рисунок 2. Ядра атомов бериллия
Наиболее стабильными конфигурациями атомов должны быть такие, в которых альфа-частица является составной частью ядра. Такими конфигурациями являются вторая, третья и четвертая. Но претендентом на основное состояние атома может быть только вторая конфигурация, потому что расчетное значение спина ядра (3/2) соответствует экспериментальным данным. В химических реакциях бериллий чаще всего двухвалентен. Из атомов с альфа-частицей в ядре двухвалентными являются третья и четвертая конфигурация. Третья конфигурация будет центром молекул, в которых угол между оконечными атомами близок к 90 градусам. Четвертая конфигурация будет центром молекул, в которых угол между оконечными атомами близок к 180 градусам. По экспериментальным данным, в молекулах F-Be-F, Cl-Be-Cl, Br-Be-Br угол равен 180 градусов. Поэтому основным возбужденным состоянием, скорее всего, является четвертая конфигурация. Остальные же конфигурации являются временными возбужденными состояниями. В атомах четвертой конфигурации уже две нуклонные пары, а не одна, как у лития, под воздействием внешних сил способны поворачиваться вокруг нейтронной оси. Этим свойством можно объяснить замечательную способность бериллия быть хорошим замедлителем нейтронов. Действительно, столкновение нейтрона с любой из двух нуклонных пар должно практически в любом случае приводить не к захвату нейтрона ядром, а к повороту нуклонной пары вокруг нейтронной оси. Нейтрон же должен отскакивать от нуклонной пары с изменением направления движения и с потерей части кинетической энергии.
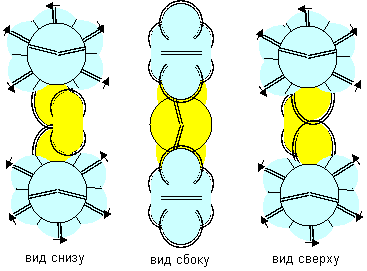
Рисунок 3. Молекула F-Be-F c атомом бериллия четвертой конфигурации
Напрямую с водородом бериллий не реагирует. Причиной может быть сложность создания условий для совместного существования атомарного водорода и свободных атомов бериллия.
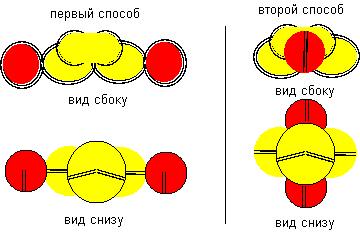
Рисунок 4. Две формы молекулы H-Be-H c атомом бериллия четвертой конфигурации
Гидрид бериллия линейного вида удается получать только разложением более сложных соединений. То есть, в молекуле атомы водорода должны находиться с противоположных сторон. Но к экваториальной форме атома бериллия атомы водорода теоретически могут прилипнуть двумя разными способами. При первом способе атомы водорода прилипают к концам электронных лепестков. При втором способе атомы водорода втягиваются в промежутки между лепестками бериллия, поэтому размеры молекулы из трех атомов должны мало отличаться от размеров одного атома бериллия, что совершенно невозможно при сферическом представлении формы атомов. Из экспериментов известно, что расстояния между ядрами атомов в молекулах меняются в зависимости от окружения. У свободных молекул в газообразном состоянии расстояния между центрами атомов обычно меньше, чем расстояния между центрами атомов у молекул в связанном кристаллическом состоянии. Можно предположить, что данный факт связан с существованием двух способов соединения атомов. В газообразном состоянии в условиях частых столкновений с другими молекулами с большой кинетической энергией преимущественно распространена компактная форма молекул. В кристаллическом же виде столкновения отсутствуют. Там появляется другой фактор – притягивание к соседним молекулам. Так как соседние молекулы присутствуют со всех сторон, то атомы в молекуле максимально растягиваются.
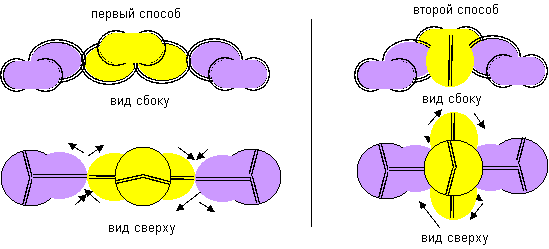
Рисунок 5. Две формы молекулы Li-Be-Li c атомом бериллия четвертой конфигурации
Сплавы бериллия с литием металлурги получают, но о соединениях бериллия с литием нет сведений. Хотя такую молекулу не сложно изобразить. Соединение с атомом бериллия четвертой конфигурации тоже может иметь две формы.
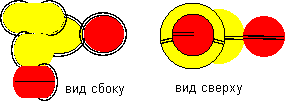
Рисунок 6. Молекулы H-Be-H c атомом бериллия третьей конфигурации
Атом бериллия третьей конфигурации тоже двухвалентен. Посмотрим, что будет, если атом такой конфигурации за время своего существования успеет стать частью молекулы.
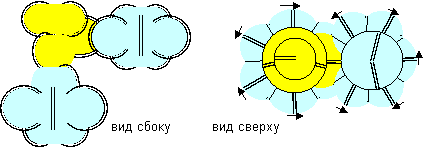
Рисунок 7. Молекулы F-Be-F c атомом бериллия третьей конфигурации
С такой конфигурацией может образовываться только одна форма молекулы, где угол между концевыми атомами близок к углу 90 градусов. Чтобы понять, как атом ведет себя в молекулах, достаточно рассмотреть химические соединения с водородом, как самым простым химическим элементом, и с фтором, как самым химически активным элементом.
Двухвалентным является также атом бериллия первой конфигурации.
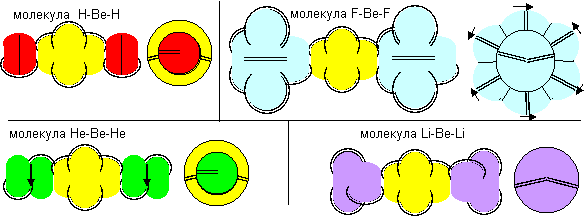
Рисунок 8. Построение молекул c атомом бериллия первой конфигурации
Теперь осталось рассмотреть поведение атомов с экзотическими валентностями. При этом, сделаем допущение, что время существования атомов в экзотических конфигурациях достаточно, чтобы успеть стать частью молекулы.
Атом бериллия второй конфигурации одновалентен.
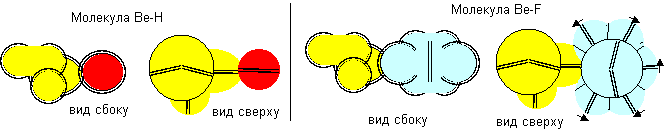
Рисунок 9. Примеры молекул c атомом бериллия второй конфигурации
Атом бериллия пятой конфигурации трехвалентен.
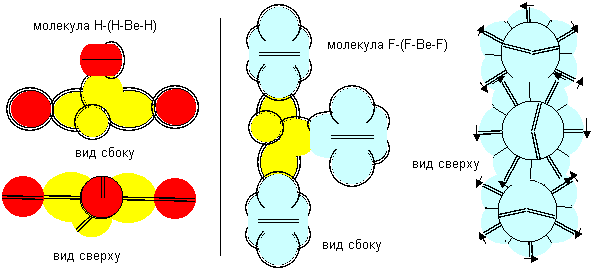
Рисунок 10. Примеры молекул c атомом бериллия пятой конфигурации.
Атом бериллия шестой конфигурации четырехвалентен. Соединение атомов водорода с атомом бериллия шестой конфигурации опять может происходить двумя разными способами. При первом способе молекула имеет рыхлую лучевую форму. Стабилизация лучей может происходить в кристаллической форме, когда атомы водорода притягивают к себе с разных сторон электронные лепестки соседних атомов. При втором способе атомы водорода втягиваются в промежутки между лепестками бериллия, поэтому размеры молекулы из пяти атомов должны мало отличаться от размеров одного атома бериллия, что совершенно невозможно при сферическом представлении формы атомов. Компактная форма должна быть присуща свободным молекулам газообразной фазы.
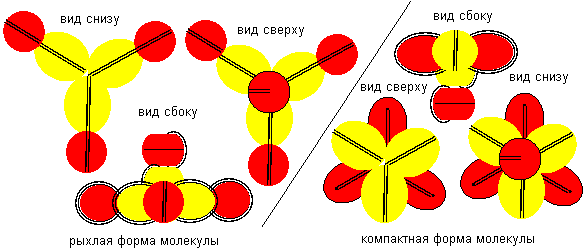
Рисунок 11. Пример молекул c атомом бериллия шестой конфигурации.
Атом бериллия седьмой конфигурации четырехвалентен.
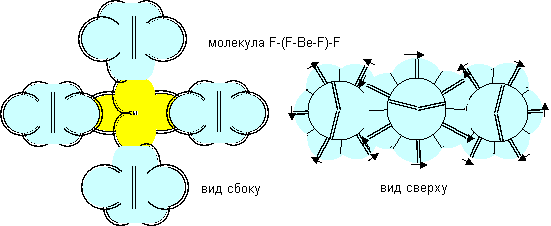
Рисунок 12. Пример молекулы c атомом бериллия седьмой конфигурации.
Особый интерес представляет атом бериллия восьмой конфигурации, у которого три электронных лепестка слипаются вместе и не способны взаимодействовать с лепестками других атомов. Только один электронный лепесток на полюсе остается химически активным.

Рисунок 13. Молекула Be-F c атомом бериллия восьмой конфигурации.
В этом состоянии атом полностью теряет металлические свойства и становится аналогом рассмотренного ранее атома лития второй конфигурации. Если бы было возможным создать условия для увеличения жизни возбужденных состояний атомов и их соприкосновения при малых кинетических энергиях, то они могли бы образовать молекулы с возбужденными состояниями других атомов, как показано на рисунке ниже. Атомы такой конфигурации различаются на правые и левые. Показанное на рисунке слипание в молекулу Be-Be возможно только из атомов противоположной ориентации.
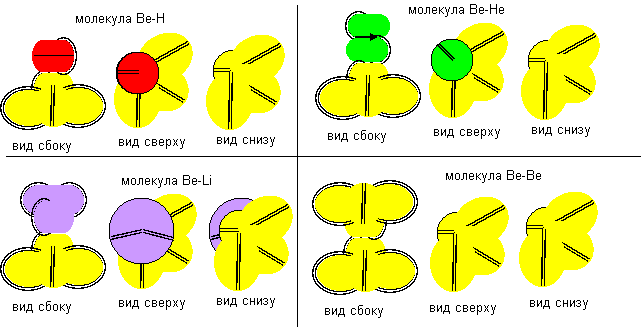
Рисунок 14. Примеры других молекул c атомом бериллия восьмой конфигурации.
Слипание возможно и атомов одинаковой ориентации, только совершенно другими способом. При слипании образуется симметричная молекула с полностью заполненным электронным слоем с шестью лепестками на экваторе и по одному осевому лепестку на каждом полюсе.
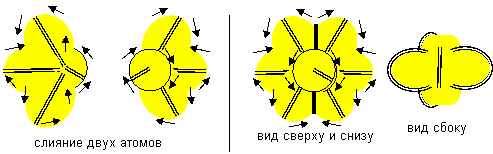
Рисунок 15. Слипание атомов восьмой конфигурации одинаковой ориентации
В отличие от предыдущей химически инертной молекулы бериллия, данная молекула бериллия химически активна и способна соединяться с другими атомами.
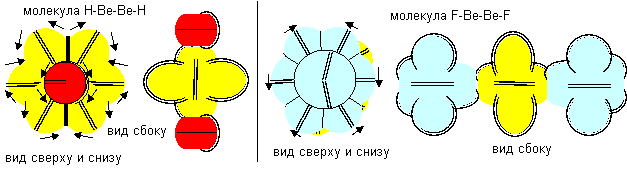
Рисунок 16. Примеры химической активности молекул бериллия
Владимир Яковлев, lun1@list.ru , http://logicphysic.narod.ru , апрель 2010 года