Вихревые модели атомов бора
У бора стабильными являются изотопы В10 и B11. Рассмотрим несколько теоретически наиболее возможных конфигураций атомов этих изотопов. Каждая конфигурация сопровождается соответствующей формулой современного математического описания.

Рисунок 1. Вероятные конфигурации атомов бора
Соответствующие этим атомам ядра изображены на рисунке ниже. Овалом обведены протоны, вращающиеся вокруг нейтронной оси. Наиболее стабильными конфигурациями атомов должны быть такие, в которых альфа-частица является составной частью ядра. Такими конфигурациями являются нулевая, первая, вторая, третья, четвертая и восьмая. В ядре первой конфигурации альфа-частиц даже две. Надо думать, что именно эта конфигурация должна быть основным состоянием атома. Но в данном случае не все так просто. Расчетное значение спина ядер не совпадает с экспериментальным значением ни для B10, ни для B11, хотя количественный состав электронных слоев атома полностью соответствует современному математическому описанию данного атома. Слои на полюсах атома с двумя электронами соответствуют двум s-слоям математического описания, а электронный лепесток на экваторе соответствует p-слою.
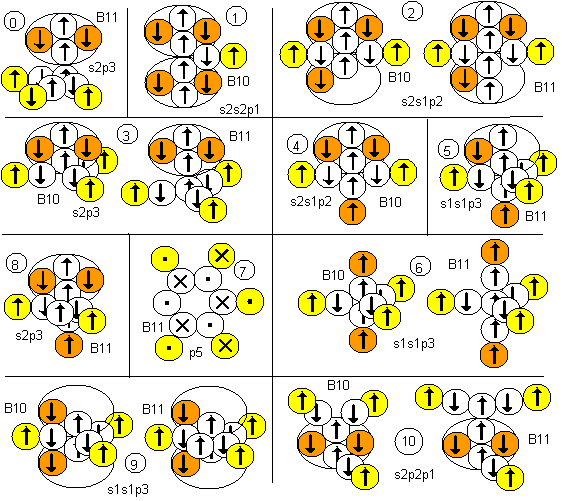
Рисунок 2. Ядра атомов бора
Экспериментальному значению основного состояния спина ядра B10(3) соответствуют третья, четвертая, девятая и десятая конфигурации. Экспериментальному значению основного состояния спина ядра B11(3/2) соответствуют нулевая и девятая конфигурации. Нулевая конфигурация химически инертна. Химические свойства третьей и девятой конфигураций идентичны, для них все углы между присоединенными атомами должны быть близки к 120 градусам. Углы между присоединенными атомами в десятой конфигурации зависят от окружения. Для четвертой конфигурации углы между присоединенными атомами должны быть близки к 180 и 90 градусам. Исследования соединений бора с галогенами выявили, что углы между атомами, присоединенными к атому бора, составляют 119-120 градусов. Это позволяет предположить, что основным состоянием атомов B10 является третья конфигурация. С нее и начнем рассматривать принципы образования молекул. В соединении со фтором возможна только единственная конфигурация молекулы F-(F-B-F) с положительной валентностью бора.
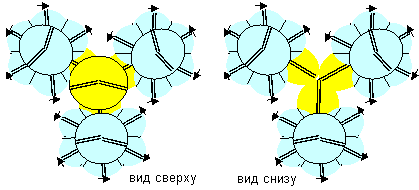
Рисунок 3. Молекула F-(F-B-F) с атомом бора третьей конфигурацией
Такая молекула будет образовываться при высокой концентрации фтора. В случае же, когда будет не хватать атомов фтора для создания завершенной молекулы с отсутствующими валентными связями, то неполноценные молекулы могут взаимодействовать друг с другом.
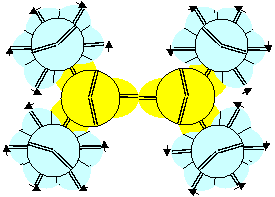
Рисунок 4. Молекула F-(F-B-B-F)-F с атомами бора третьей конфигурацией
Так же, как и бериллий, напрямую с водородом бор не реагирует. Причиной может быть сложность создания условий для совместного существования атомарного водорода и свободных атомов бора. Бороводороды удается получать только разложением более сложных соединений. К такой форме атома бора атомы водорода теоретически могут прилипнуть двумя разными способами. При первом способе атомы водорода прилипают к концам электронных лепестков, в этом случае никакие электронные лепестки никуда не втягиваются, то есть атомы обладают нейтральной валентностью. Такие молекулы должны принадлежать кристаллам.
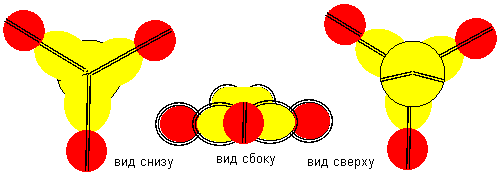
Рисунок 5. Молекула H-(H-B-H) с нейтральной валентностью бора 3 конфигурации
При втором способе атомы водорода втягиваются в промежутки между лепестками бора, при втором способе молекула получается более компактной. Размеры молекулы из четырех атомов должны мало отличаться от размеров одного атома бора, что совершенно невозможно при сферическом представлении формы атомов. Такие молекулы должны существовать в газообразном агрегатном состоянии.

Рисунок 6. Молекула H-(H-B-H) с отрицательной валентностью бора 3 конфигурации
С теоретической точки зрения никаких запретов не существует и на взаимодействие бора с литием, поэтому изобразим вид и компактной и рыхлой молекулы..
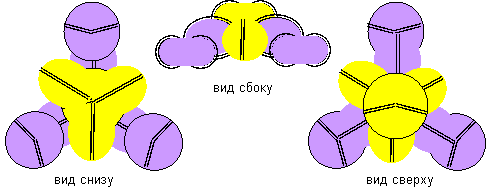
Рисунок 7. Молекула Li-(Li-B-Li) с отрицательной валентностью бора 3 конфигурации
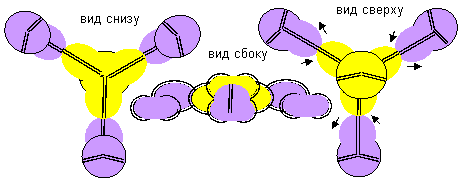
Рисунок 8. Молекула Li-(Li-B-Li) с положительной валентностью бора 3 конфигурации
Все соединения с участием атомов с такой конфигурацией имеют плоскую форму. Могут образовываться и замкнутые цепочки типа бензольного кольца.
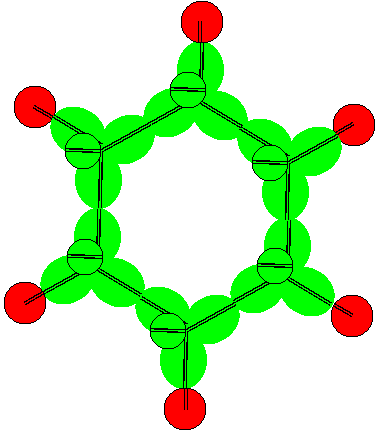
Рисунок 9. Аналог молекулы бензола из атомов бора 9 конфигурации
Принципы химической активности атомов шестой конфигурации достаточно рассмотреть на примерах соединений с водородом и со фтором.
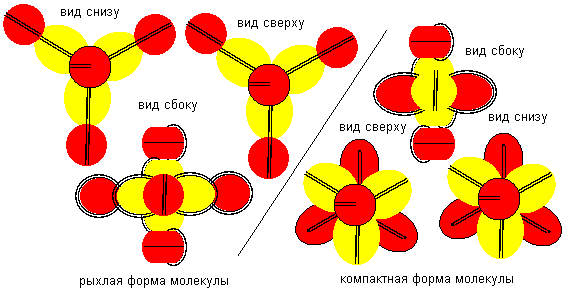
Рисунок 10. Соединение атомов водорода c атомом бора шестой конфигурации.
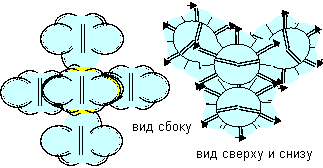
Рисунок 11. Соединение атомов фтора c атомом бора шестой конфигурации.
Интересной особенностью обладают атомы нулевой конфигурации. Хотя они и химически инертны, но способны слипаться друг с другом особым способом. При слипании образуется симметричная молекула с полностью заполненным электронным слоем с шестью лепестками на экваторе и с полностью законченными двухэлектронными электронными слоями на полюсах. Молекула химически инертна и является полной копией атома неона.
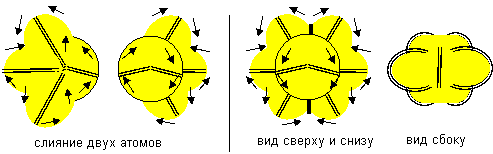
Рисунок 12. Слипание атомов бора нулевой конфигурации одинаковой ориентации
Атом бора четвертой конфигурации является полным химическим аналогом атома бериллия пятой конфигурации, Поэтому нет никакого смысла показывать для него структуру молекул. Атом бора первой конфигурации является химическим аналогом атома лития первой конфигурации. Атом бора второй конфигурации является химическим аналогом атома лития пятой конфигурации. Атом бора пятой конфигурации является химическим аналогом атома бериллия шестой конфигурации. Атом бора седьмой конфигурации является химическим аналогом атома фтора с лепестковой вакансией в боку.
Владимир Яковлев, lun1@list.ru , http://logicphysic.narod.ru , апрель 2010 года