Вихревые модели атомов углерода
У углерода стабильными являются изотопы C12 и C13. Рассмотрим несколько теоретически наиболее возможных конфигураций атомов этих изотопов. Каждая конфигурация сопровождается соответствующей формулой современного математического описания.
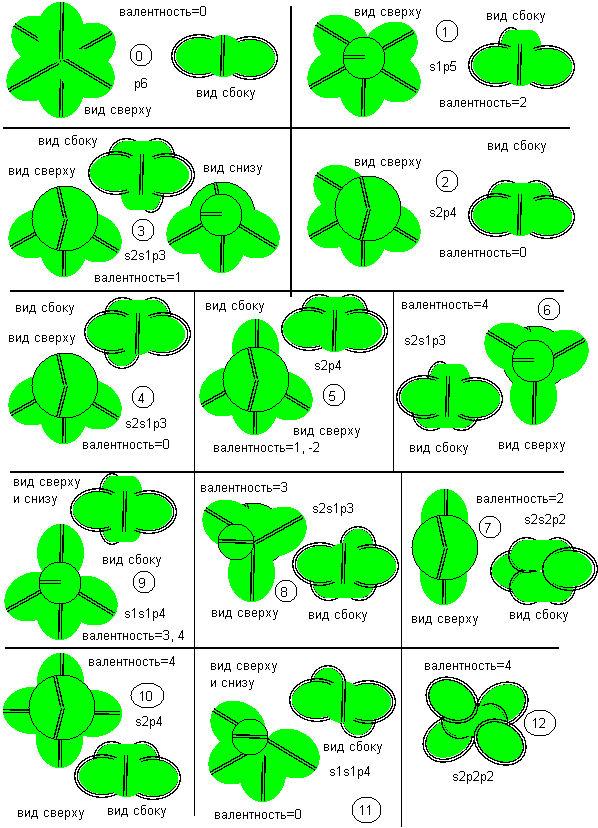
Рисунок 1. Вероятные конфигурации атомов углерода
Соответствующие этим атомам ядра изображены на рисунке ниже. Овалом обведены протоны, вращающиеся вокруг нейтронной оси. На этот раз рисунки конфигураций расположены так, чтобы рядом располагались конфигурации, переходящие друг в друга при том или ином возбуждении атома: 0-1, 1-2, 2-3, 2-5, 3-4, 4-5, 4-7, 5-6, 6-7, 6-9, 7-8, 8-9, 5-10, 6-10, 8-10.

Рисунок 2. Ядра атомов углерода
Экспериментальному значению основного состояния спина ядра C12 (0) и спина ядра C13 (1/2) соответствуют нулевая, вторая и одиннадцатая конфигурация. Для определения конфигурации, соответствующей основному состоянию, требуется дополнительный параметр. Наиболее химически активной должна быть первая конфигурация, так как она имеет строение, похожее на самый химически активный атом фтора. Конфигурация двухвалентна, угол между связями должен быть близок к 90 градусам. Полюсная связь нейтральной валентности, а экваториальная связь отрицательной валентности. Относительно полюсной валентности атомы делятся на правые и левые.
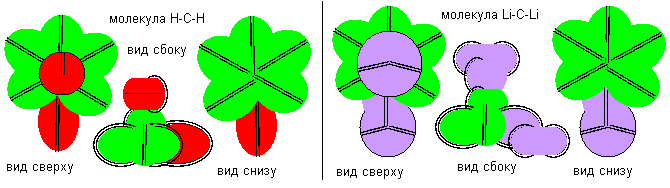
Рисунок 3. Примеры молекул с атомом углерода первой конфигурации
Наименее химически активной должна быть третья конфигурация, так как она обладает только одной нейтральной валентностью. По химическим свойствам эта конфигурация должна быть аналогом атома фтора с полюсной валентной связью, атома гелия осевого варианта, атома лития второй конфигурации, атома бериллия восьмой конфигурации. Атомы химически различимы, в зависимости от того, на каком из полюсов имеется лепестковая вакансия. Это связано с тем, что направление вращения орбитального электрона жестко связано с направлением вращения осевого протона в ядре. Если расположить атомы одинаково (осевым лепестком вверх), то можно условно поделить их на левые и правые. Слипаться между собой способны только атомы противоположного типа.
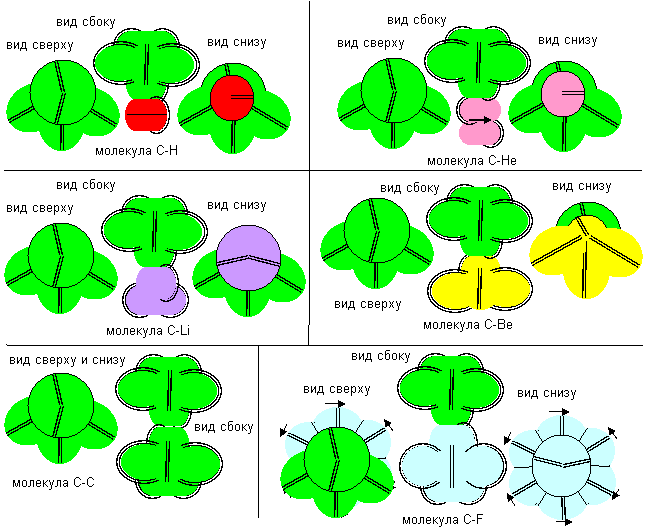
Рисунок 4. Примеры молекул с атомом углерода третьей конфигурации
Атомы пятой конфигурации в разных молекулах могут иметь разную валентность. В соединениях с атомами фтора отрицательной валентности и с атомами бора седьмой конфигурации для связи используется одинокий электронный лепесток. В этом случае валентность положительна и равна единице.
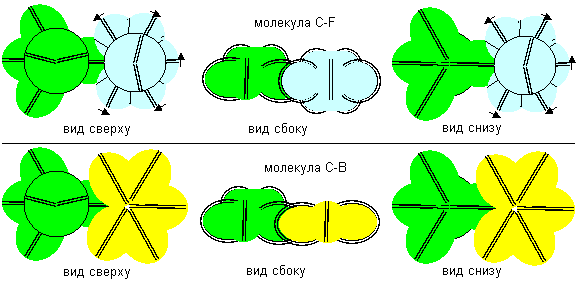
Рисунок 5. Положительная валентность атома углерода пятой конфигурации
В соединениях с атомами водорода и с атомами лития первой конфигурации для связи используются две электронные вакансии, втягивающие внутрь атома электронные лепестки других атомов. В этом случае валентность отрицательна и равна двум. Если допустить, что нуклоны имеют идеальную сферическую форму, а размеры нейтрона и протона одинаковы, то расчетное значение угла между валентными связями равно 109, 5 градусов.
.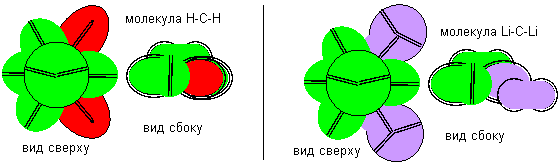
Рисунок 6. Отрицательная валентность атома углерода пятой конфигурации
У атомов шестой конфигурации одна полюсная валентная связь всегда нейтральна. А три экваториальные валентные связи могут быть как положительными, так и отрицательными.
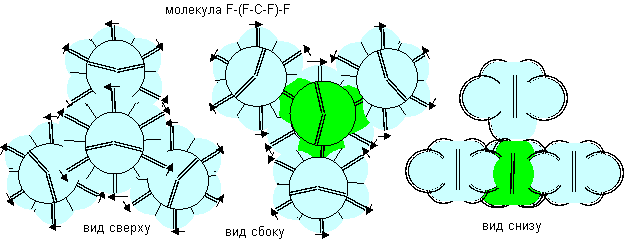
Рисунок 7. Положительная валентность атома углерода шестой конфигурации
В соединениях с атомами фтора отрицательной валентности в атомы фтора втягиваются экваториальные электронные лепестки. Атомы углерода отдают свои электронные лепестки, поэтому эти три валентные связи в данном случае являются положительными.
В соединениях с атомами водорода и с атомами лития первой конфигурации для связи используются три экваториальные электронные вакансии, втягивающие внутрь атома электронные лепестки других атомов. В этом случае валентность трех экваториальных связей отрицательна. При отсутствии взаимодействия между экваториальными связями и нейтральной связью углы между экваториальными связями должны быть близки к 120 градусам, а углы между экваториальными связями и нейтральной связью должны быть близки к 90 градусам.
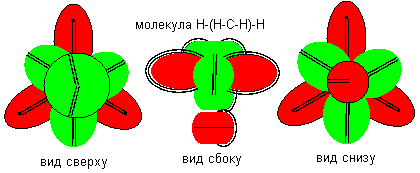
Рисунок 8. Отрицательная валентность атома углерода шестой конфигурации
Четырехвалентный углерод в соединении с водородом образует молекулу метана. Несколько десятков лет считалось, что молекула метана имеет тетраэдрическую форму, атом углерода находится в центре тетраэдра и все четыре валентности в атоме углерода равнозначны. Изображенную выше молекулу с некоторой натяжкой можно назвать тетраэдрической, если экваториальные связи отталкиваются от полярной связи. Но равнозначными являются только три связи из четырех. Более всего ближе к данному описанию гидрид углерода с атомом углерода двенадцатой конфигурации.
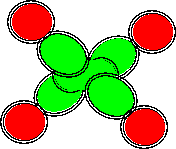
Рисунок 9. Соединение с водородом атома углерода двенадцатой конфигурации
Исследования молекулы метана в лаборатории Цюриха под руководством Виктора Анри показали, что атомы, скорее всего, имеют гибкую структуру. Некоторые производные молекулы метана имеют форму тетраэдра, но сама молекула метана имеет не структуру тетраэдра, а структуру пирамиды, в которой расстояния между атомами водорода равны 1.05 ангстрема, расстояния между атомом углерода и атомами водорода равно 1.15 ангстрем, а высота пирамиды равна 0.37 ангстрема.

Рисунок 10. Соединение с водородом атома углерода десятой конфигурации
Под такое описание больше подходит молекула с центром в виде атома углерода десятой конфигурации. Но такой атом навряд ли может существовать физически по причине высокой степени отталкивания нуклонов ядра с одним направлением спина. Исследования спектров ионизированных атомов углерода показывают, что в атоме углерода четыре валентности неравнозначны - две валентности одного типа, а другие две валентности другого типа. Больше всего такое описание подходит для молекулы с атомом углерода девятой конфигурации. Можно сделать предположение, что атомы углерода в зависимости от внешних условий могут иметь ту или иную форму. Экспериментальные измерения меняют внешние условия, поэтому разные эксперименты могут изучать атомы разной конфигурации.
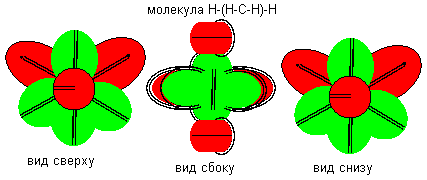
Рисунок 11. Соединение с водородом атома углерода девятой конфигурации
Атом углерода седьмой конфигурации является химическим аналогом атома лития пятой конфигурации. Атом углерода восьмой конфигурации является химическим аналогом атома бора третьей конфигурации. Атомы углерода одиннадцатой конфигурации химически инертны, но слипание их друг с другом теоретически возможно показанном на рисунке ниже способом. Аналогичным способом должны слипаться также атомы третьей и четвертой конфигураций. Такое слипание было показано ранее на примере атомов бора нулевой конфигурации.

Рисунок 12. Слипание атомов углерода одиннадцатой конфигурации
Во многих соединениях атомы углерода четырехвалентны. В этом случае в соединениях могут участвовать только атомы шестой, девятой или двенадцатой конфигураций (учитывая низкую вероятность существования атомов десятой конфигурации). В длинных углеродных цепях, из-за особенностей строения, атомы углерода располагаются не на одной прямой, а зигзагообразно.
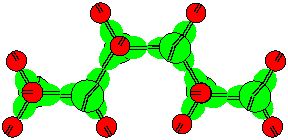
Рисунок 13. Молекула гексана из атомов углерода шестой конфигурации
Владимир Яковлев, lun1@list.ru , http://logicphysic.narod.ru , апрель 2010 года