Вихревые модели атомов азота
У азота стабильными являются изотопы N14 и N15. Рассмотрим несколько теоретически наиболее возможных конфигураций атомов этих изотопов. Каждая конфигурация сопровождается соответствующей формулой современного математического описания.

Рисунок 1. Вероятные конфигурации атомов азота
Соответствующие этим атомам ядра изображены на рисунке ниже. Овалом обведены протоны, вращающиеся вокруг нейтронной оси. Экспериментальному значению основного состояния спина ядра N14(1) соответствуют нулевая, первая и пятая конфигурация. Экспериментальному значению основного состояния спина ядра N15 (1/2) соответствует химически инертная девятая конфигурация. Главным претендентом на основное состояние ядра N14 является пятая конфигурация. Во-первых, это единственная химически инертная конфигурация. Все остальные конфигурации, кроме нулевой, являются сильными химическими агрессорами. То есть, малейшее возбуждение азотосодержащих веществ должно приводить к цепной химической реакции, что подтверждается экспериментом. На этой особенности создаются взрывчатые вещества. Во-вторых, количественный состав электронных слоев данной конфигурации полностью соответствует современному математическому описанию данного атома. В–третьих, данная конфигурация содержит две альфа-частицы, поэтому обладает максимальной энергией связи. В-четвертых, данная конфигурация является самой компактной.

Рисунок 2. Ядра атомов азота
Химические свойства атома азота третьей конфигурации достаточно показать на соединении с водородом и литием.
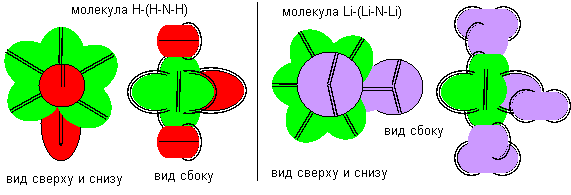
Рисунок 3. Примеры молекул c атомом бериллия третьей конфигурации
Химические свойства атома азота нулевой конфигурации должны быть идентичны химическим свойствам осевого атома гелия, атома фтора с осевым лепестком. Химические свойства атома азота первой конфигурации должны быть идентичны химическим свойствам атома фтора с электронной вакансией в боку, атома бора седьмой конфигурации. Химические свойства атома азота второй конфигурации должны быть идентичны химическим свойствам атома углерода первой конфигурации. Химические свойства атома азота четвертой конфигурации должны быть идентичны химическим свойствам атома бериллия шестой конфигурации. Химические свойства атома азота шестой конфигурации должны быть идентичны химическим свойствам атома углерода пятой конфигурации. Химические свойства атома азота седьмой конфигурации должны быть идентичны химическим свойствам атома бора третьей конфигурации.

Рисунок 4. Слипание атомов азота нейтральными связями
Атомы азота обладают замечательной способностью – они могут взаимодействовать друг с другом в абсолютном большинстве случаев. Выше показаны способы слипания атомов нейтральными связями, ниже – способы слипания атомов химически агрессивными связями.

Рисунок 5. Слипание химически агрессивных атомов азота
Слипание возможно даже между инертными атомами азота, претендентами на основное состояние. В этом случае по три экваториальных лепестка от каждого атома формируют законченный электронный слой из шести электронных лепестков. Законченные электронные оболочки из двух электронов на полюсах атомов тоже не должны препятствовать слипанию. Эти электронные оболочки представляют собой подобие пропеллера. Если лопасти пропеллеров в месте соприкосновения вращаются в одну сторону с одинаковой скоростью, то их оси могут сблизиться на расстояние, на много меньшее длины лопастей пропеллеров. Данная молекула химически инертна и состоит из наиболее устойчивых атомов. Это означает, что все другие соединения атомов азота должны при возбуждении перейти в данное состояние.
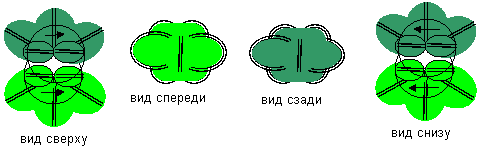
Рисунок 6. Слипание инертных атомов азота
Описание соединений атомов восьмой конфигурации затрудняется в связи со сложностью трехмерного изображения таких соединений с разных точек зрения. Достаточно показать соединение с атомами водорода.
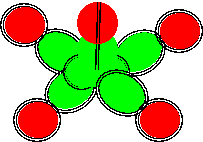
Рисунок 7. Слипание с водородом атома азота восьмой конфигурации
Владимир Яковлев, lun1@list.ru , http://logicphysic.narod.ru , апрель 2010 года