Вихревые модели атомов фтора
Ранее упоминалось, что большинство состояний легкого атома может быть получено либо из модели атома Ar36, либо из модели атома Ne20 путем удаления из ядра модели того или иного количества нуклонов. При этом, в электронной оболочке атома пропадет соответствующее количество электронных лепестков. Чтобы получить наиболее вероятные состояния атома фтора, нужно из модели атома неона удалить один электронный лепесток. Удалить его можно двумя разными способами - либо с торцов атома, либо из центральной ромашки.
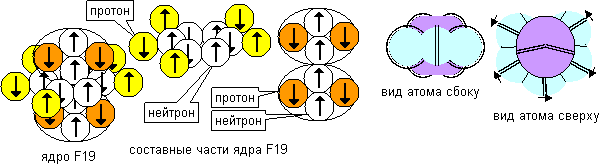
Рисунок 1. Конфигурация атома фтора с лепестковой вакансией в боку
При удалении электронного лепестка из центральной ромашки в боку атома появляется лепестковая вакансия, которая может втянуть во внутрь химически активный электронный лепесток другого сложного атома или растянутый атом водорода орбитальной модели, то есть атом будет обладать отрицательной валентностью. Атом, электронный лепесток которого имеет способность растягиваться и втягиваться в лепестковую вакансию, будет обладать положительной валентностью. Фтор считается самым агрессивным элементом. Именно в этом состоянии атом наиболее агрессивен, так как втягивает электронные лепестки других атомов на больших расстояниях. Причина агрессивности кроется в наличии в атоме лепестковой вакансии, создающей силу притяжения для электронного лепестка чужого атома. Единственным ограничением возможности химической реакции является несоответствие ориентации в пространстве. Атомы должны быть так ориентированы, чтобы совпадали общие электронные потоки в местах соприкосновения электронных лепестков.
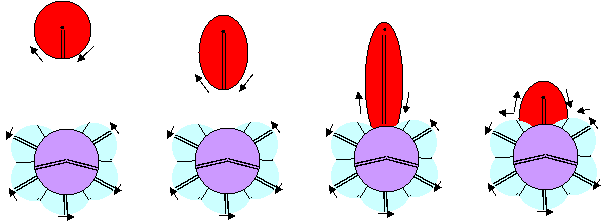
Рисунок 2. Разные стадии втягивания атома водорода в атом фтора
Рассмотрим химическую реакцию с втягиванием электронного лепестка в системе отсчета с неподвижным атомом фтора. Процесс втягивания должен начинаться с оттягивания к атому фтора электронного облака одного из электронных лепестков другого атома. Затем, когда электрон чужого атома значительное время будет проводить внутри атома фтора, к атому фтора кулоновскими силами будет подтягиваться и ядро чужого атома. Если же чужое ядро по каким-либо причинам отрывается, то образуется ион фтора, конфигурация которого полностью совпадает с конфигурацией молекулы фтористого водорода с экваториальной связью. Ион фтора так же, как и молекула фтористого водорода, по своим размерам должны мало отличаться от размеров атома фтора.
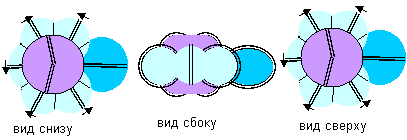
Рисунок 3. Конфигурация иона фтора
Количественный состав электронных слоев атома с дыркой в ромашке полностью соответствует современному математическому описанию данного атома, но физическое представление отличается от официальной интерпретации математического описания. Слои на полюсах атома с двумя электронами соответствуют двум s-слоям математического описания, а слой в середине с пятью электронами соответствует p-слою. Однако конфигурация с лепестковой вакансией в боку должна быть возбужденным состоянием атома, так как вычисленное значение спина ядра (3/2) не соответствует экспериментальным данным для основного состояния атома. Атомы с такой конфигурацией могут находиться в двух состояниях с одинаковыми химическими свойствами, но с разными физическими свойствами. Если направление спинов нейтронов нейтронной оси принять за положительное, то спин ядра может иметь два значения: “-3/2” или “+3/2” в зависимости от направления спина отсутствующего протона
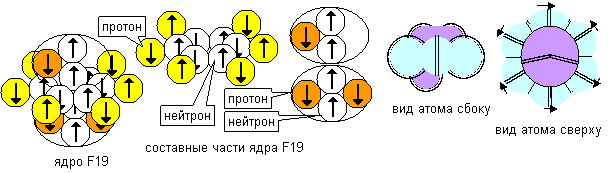
Рисунок 4. Конфигурация атома фтора с вращающимся лепестком
При удалении электронного лепестка с одного из полюсов оставшийся на полюсе единственный лепесток либо будет продолжать вращаться вокруг оси атома, либо повернется и сольется с осью атома. При вращении лепестка атом будет химически инертным. Согласно современному математическому описанию, это состояние будет соответствовать формуле s2s1p6. Вычисленное значение спина равно 1/2, что соответствует экспериментальному значению основного состояния. То есть, данная конфигурация является основным претендентом на основное состояние атома. Атомы с такой конфигурацией опять могут находиться в двух состояниях с одинаковыми химическими свойствами, но с разными физическими свойствами, потому что отсутствующий электронный лепесток может быть на одном из двух полюсов. Разницу можно физически определить по отношению к направлению спинов нейтронов нейтронной оси.
Повернутый к оси лепесток изменится и приобретет тороподобную форму со спином ядра, равным 3/2. Хотя новое состояние по-прежнему будет соответствовать формуле s2s1p6 современного математического описания, но атом из химически инертного превратится в химически активный, но менее агрессивный по сравнению с состоянием с вакансией в центре. И вновь атомы с такой конфигурацией могут находиться в двух состояниях с одинаковыми химическими свойствами, но с разными физическими свойствами, потому что единственный электронный лепесток может быть на одном из двух полюсов атома.
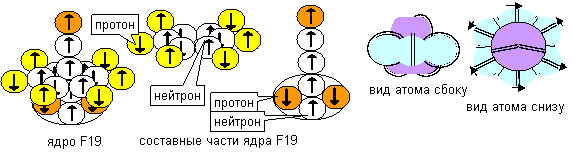
Рисунок 5. Конфигурация атома фтора с осевым лепестком
На этом примере можно убедиться, что современное математическое описание атома является, если мягко сказать, неполным. Оно не позволяет математически разделить состояния атома с разными физическими (масса атома и его форма) и химическими свойствами (валентность и степень химической агрессивности). Парадокс, но на этом фоне описание ядра атома кажется более полным. Так, для ядра атома того же изотопа F19 известно несколько десятков энергетических уровней, каждый из которых характеризуется средним временем жизни, спином, четностью, магнитным моментом, степенью отклонения от сферической формы.
Есть еще одно свойство, которое не охвачено современным математическим описанием атома. Атомы химически различимы, в зависимости от того, на каком из полюсов имеется лепестковая вакансия. Это связано с тем, что направление вращения орбитального электрона жестко связано с направлением вращения осевого протона в ядре. Если расположить атомы одинаково (осевым лепестком вверх), то можно условно поделить их на левые и правые. Слипаться между собой способны только атомы противоположного типа. Если количество левых и правых атомов разное, то в газовой смеси кроме молекул фтора всегда будут оставаться свободные атомы, которые не будут вступать в химическую реакцию друг с другом ни при каких условиях.
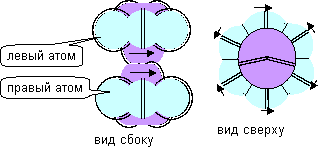
Рисунок 6. Молекула фтора с полюсной связью
В молекулах, где атомы слипаются торцевыми лепестками, связь будет равноценна со стороны каждого атома, поэтому валентность можно назвать нейтральной, но никак не положительной или отрицательной. Экспериментаторам удалось зафиксировать случаи соединения атома гелия и атома фтора. Модель молекулы такого соединения можно представить единственным способом как слипание атома гелия осевого типа с атомом фтора с осевым лепестком. Любой атом гелия может слипаться и с правыми, и с левыми атомами фтора, он только должен повернуться к атому фтора нужным полюсом.
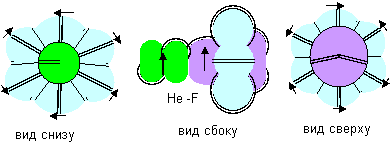
Рисунок 7. Молекула фтористого гелия с полюсной связью
Химическая связь торцами атомов должна быть относительно слабой и образовываться может только при тесном контакте во время столкновений. Поэтому не каждое столкновение может закончиться химической реакцией, а только то, при котором атомы сталкиваются химически активными торцами. Химически активные конфигурации с разной валентностью формируют и молекулы разной формы. Молекулы фтористого водорода (H-F), например, могут иметь две формы – одна форма с экваториальной связью, рассмотренная выше, а другая форма с полюсной связью показана ниже на рисунке. .
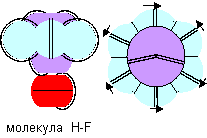
Рисунок 8. Молекула фтористого водорода с полюсной связью
Владимир Яковлев, lun1@list.ru , http://logicphysic.narod.ru , апрель 2010 года