Содержание основных положений пирамидной модели ядер атомов
- Внутреннее строение атома водорода.
- Графические обозначения нуклонов.
- Физические причины проявления ядерных сил.
- Принципы взаимодействия нуклонов.
- Физическая сущность дефекта масс.
- Строение многоэлектронного атома.
- Физические причины квантования электронных орбит в атоме.
- Место и роль нейтрона в ядре.
- Место и роль протона в ядре.
- Взаимопревращения протона и нейтрона в ядре атома.
- Физические причины существования химически активных атомов.
- Процессы излучения-поглощения атомом кванта света.
- Физические причины смещения спектра излучения.
- Принципы распределения протонов и нейтронов в ядрах атомов.
- Вычисление спина и четности ядра атома по известной конфигурации.
- Строение атома гелия и его ядра.
- Физические причины существования инертных атомов.
- Физическая сущность изомерных состояний атомов.
- Необходимость расширения классификации атомов.
- Кристаллические и капельные свойства ядер.
- Причины необходимости механического воздействия для начала химической реакции.
- Принципы изоляции кулоновского взаимодействия протонов.
- Физический смысл ядерных оболочек.
- Соотношение количества нейтронов и протонов в долгоживущих ядрах атомов.
- Конфигурации ядер атомов с положительной валентностью, с осевым нейтроном.
- Конфигурации ядер атомов с положительной валентностью, без осевого нейтрона.
- Особенности конфигураций ядер атомов с отрицательной валентностью.
- Конфигурации ядер со смешанной валентностью.
- Зеркальные ядра (Li7, Be7)
- Особенности конфигураций ядер инертных атомов.
- Сцепление ядерных слоев нуклонной осью.
- Сцепление плоских ядерных слоев нейтронными кольцами.
- Вероятность существования ядра в каком-либо состоянии.
- Варианты основных состояний четно-четных ядер с N=P.
- Варианты основных состояний четно-четных ядер c N>P.
- Физические причины существования разной валентности.
- Физические причины феномена магических чисел.
- Расчет энергии связи ядра.
- Периодичность химических свойств элементов первого и второго периода.
- Периодичность химических свойств элементов четвертого периода.
- Периодичность химических свойств элементов пятого периода.
- Периодичность химических свойств элементов шестого периода.
- Периодичность химических свойств элементов седьмого периода.
- Определение параметров элементов острова стабильности.
Основные положения модели
1 Cтроение электрона и протона, физические основы электрических сил были рассмотрены автором в основных положениях вихревой двухколечной модели стабильных элементарных частиц материи. В данной модели электрон и протон имеют вид комбинации двух вихревых колец – слипшихся задними торцами в электроне и передними торцами в протоне. Электрические свойства частиц определяются джетами – воронкообразными вихрями, формируемые кольцевым вращением от торцов на оси вращения. Рано или поздно, во время процесса сближения протона и электрона, под действием электрических сил, сливаются в единый вихрь джеты обеих частиц, в результате чего образуется атом водорода. Из-за наличия свойств инерции, при сближении происходит не столкновение частиц, а вращение вокруг центра масс. После прекращения всех переходных процессов на орбите с установившимся балансом сил притяжения и отталкивания, электрон должен вращаться в экваториальной плоскости протона по эллиптической траектории, частным случаем которой является круговая траектория. Сам электрон способен создать только электронный диск в виде растянутого обруча. А джеты, при вовлечении во вращение окружающий эфир, создают объемную оболочку атома, защищающую со всех сторон от проникновения во внутрь частиц с малой энергией. Примитивным аналогом атома водорода является девочка, прыгающая со скакалкой, к середине которой привязан маленький легкий предмет. Быстро вращающаяся скакалка сформирует реально наблюдаемую глазом оболочку. Если предмет, подобный раскручиваемому объекту, кинуть в эту оболочку, то с большой вероятностью он может отскочить от нее. Но чем больше его скорость, тем больше вероятность, что он проскочит оболочку насквозь.

Рис.1. Атом водорода без оболочки и с оболочкой
При определенных вынужденных условиях, электрон падает на протон и продолжает вращаться вокруг него по экваториальной ложбинке. Здесь формируется новый баланс сил притяжения и отталкивания. Кулоновские силы толкают электрон и протон друг к другу, а извергающийся из экваториальной ложбинки эфир отталкивает электрон. Атом водорода и нейтрон не участвуют в кулоновских взаимодействиях, потому что в них джеты электрона и протона связаны друг с другом в единый вихрь и не распространяются в пространстве.
2 Нейтрон будем обозначать белым кругом, а протон – цветным. Направление вектора спина будет указывать стрелка внутри круга. Будем считать, что наличие спина сопровождается у нуклонов наличием экватора и полюсов. Стрелка одновременно указывает и направление от одного полюса к другому. Плоскость экватора проходит посередине нуклона и перпендикулярна вектору спина. Если вектор спина перпендикулярен плоскости рисунка, то крестиком обозначается направление от наблюдателя, а точкой обозначается направление к наблюдателю.
![]()
Рисунок 2. Графические обозначения нуклонов
3 Кулоновское взаимодействие протонов, осуществляемое джетами, которые формируются за пределами полюсов, начинает проявляться только на расстояниях между полюсами соседних протонов, больших размера протона. На меньших расстояниях джеты просто не успевают сформироваться. Поэтому при тесном соприкосновении протонов кулоновское взаимодействие можно не учитывать. На таких малых расстояниях действуют только ядерные силы. Физической причиной проявления ядерных сил является вихревое взаимодействие вихревых колец в составе протона и нейтрона, вихревое поле которых затухает в пространстве пропорционально кубу расстояния. Поэтому на малом расстоянии нуклоны взаимодействуют только по правилам взаимодействия вихрей. По этим правилам нуклоны могут слипаться и торцами и экваторами, если в месте слипания одинаковое направление и кольцевого и тороидального вращения вихревых колец.
4 Возможные варианты разрешенных контактов нуклонов показаны на рисунке ниже.
![]()
Рисунок 3. Разрешенные контакты двух нуклонов
Следует особо отметить, что крайний справа вариант слипания теоретически возможен, потому что при тесном соприкосновении протонов джеты и сопутствующие им кулоновские силы не формируются. Так как протон составляет единый комплекс с одним из электронных лепестков атома, то слипаться он может только с одним из внутренних нуклонов, то есть только с одним из нейтронов ядра. Поэтому два крайних справа варианта в долгоживущих атомах вообще не реализуются. Если в ядре между торцами протонов, находящихся на одной линии, есть промежуток, то кулоновское отталкивание протонов исключается только с помощью экранирования. В противном случае ядро атома либо меняет конфигурацию, либо разваливается кулоновскими силами.
5 Слипание сопровождается давлением вихревых колец нуклонов друг на друга, которое нарушает баланс сил в каждом кольце. Усиленное внешнее давление сильнее сжимает кольца. Лишний объем эфира, который не умещается в новую одежду меньшего размера, сбрасывается в окружающую среду через передние торцы. Здесь он превращается в направленный поток эфира, который разгоняет другие объекты, находящиеся на пути потока, увеличивая их кинетическую энергию. У вихревых колец уменьшается масса, но увеличивается скорость вращения (закон сохранения момента вращения). Процесс слипания заканчивается установлением нового баланса сил в каждом вихревом кольце. Уменьшение массы при слипании называется дефектом масс. Чем он больше, тем больше притяжение, тем больше энергии нужно для отрыва нуклонов друг от друга. Поэтому дефект масс принято переводить в единицы энергии, а саму энергию принято называть энергией связи.
6 Фундаментальное положение модели - периодичность химических свойств и периодичность строения электронных оболочек атома жестко связаны с периодичностью строения его ядра. Так как электроны намного меньше ядра атома и массой и размерами, то все физические и химические свойства атома определяются строением ядра. Форма электронной оболочки атома зависит от формы и структуры ядра. Объемное распределение нейтронов и протонов в ядре является причиной, а конфигурация электронной оболочки является следствием этой причины. Каждый протон ядра двумя своими джетами механически связан только с одним электроном оболочки атома. Этот электрон вращается вокруг протона по одной из квантованных эллиптических орбит. В большинстве случаев траектории электронных орбит простираются от границы атома до экваториальной ложбины протона. При своем движении электрон и его джеты увлекают во вращение окружающую среду, образуя электронный лепесток. Совокупность всех электронных лепестков и есть электронная оболочка атома.
7 Причина квантования электронных орбит скрыта в механизме механического взаимодействия связанных друг с другом одного электрона и одного протона, каждый из которых вращается вокруг собственной оси. Квантование, вообще, повсеместно распространено в механических системах, имеющих колебательные и вращательные степени свободы, и наблюдается даже в системах астрономического масштаба. По экспериментально выведенной формуле (закон Боде-Тициуса), орбиты планет квантуются. По этому закону расстояния планет до некой воображаемой сферы, радиусом 0,4 а.е., подчиняются геометрической прогрессии - каждое следующее расстояние в два раза больше предыдущего. По этому закону Юпитер не пятая, а шестая планета. Место пятой планеты занимает пояс астероидов. Мало того, процесс квантования продолжается в планетных системах. Самым ярким примером является система Земля-Луна. Луна повернута к Земле всегда одной и той же стороной. Это значит, что за время существования системы Земля-Луна собственное вращение Луны вокруг своей оси полностью успело засинхронизироваться с вращением Луны вокруг Земли.
8 Нейтроны могут быть стабильными только в ядре атома. Вне ядра нейтроны долго не живут. Согласно экспериментальным данным, нейтрон, также как и атом водорода, распадается на электрон и протон. Тогда вполне логично предположить, что нейтрон является аналогом атома водорода. Только у него электрон занимает максимально близкую к протону орбиту. Такую орбиту он может занимать только при отсутствии возбуждающих факторов, а именно - в центре ядра атома. Вся совокупность нейтронов в центре ядра является каркасом для пространственного распределения протонов. Нейтрон, расположенный на поверхности ядра, не имеет защитного барьера от внешних толчков. Любой толчок может привести к возбуждению электрона. При этом электронная оболочка нейтрона превращается в электронную оболочку атома, а на месте нейтрона в ядре атома остается только его ядро - протон.
9 Протон в ядре следует рассматривать как единую систему вместе с окружающей его электронной оболочкой. Если электронная оболочка возбуждена, то она является частью общей оболочки атома. Если не возбуждена, то является оболочкой только одного нейтрона. Внутри ядра все нуклоны являются нейтронами. Электронная оболочка внутреннего нейтрона не может возбудиться, так как окружена со всех сторон другими нуклонами. На поверхности ядра электронная оболочка нейтрона под действием внешних толчков может возбудиться и стать частью общей оболочки атома. На поверхности же ядра остается протон, который был ядром нейтрона.
10 Если протон в результате внешнего воздействия попадает внутрь ядра, то связанный с ним электрон при очередном сближении с протоном попадает в ловушку - ему блокируется доступ за пределы ядра. После некоторого времени переходных процессов он вынужден уже вращаться по стационарной круговой орбите по экваториальной ложбине протона. В результате такого захвата электрона с электронной оболочки атома происходит превращение протона в нейтрон. Может происходить и обратное явление. Если нейтрон переместится на окраину ядра, то в результате внешних воздействий электрон может покинуть стационарную орбиту в нейтроне и стать составной частью электронной оболочки атома.
11 Если электронный лепесток одинок, то при одном и том же состоянии энергии электрона, по поправкам Зоммерфельда, форма траектории электрона может изменяться. При этом электронный лепесток либо толстеет и сильно укорачивается, либо худеет и сильно удлиняется. И в моменты удлинения резко повышается вероятность соприкосновения и слипания с подобным электронным лепестком какого-либо другого атома. Слипание осуществляется по законам взаимодействия вихрей, при этом образуется механическое соединение атомов. Совсем другие события происходят, если рядом с электронным лепестком находятся соседи – другие электронные лепестки данного атома. В этом случае форма траектории электрона резко искажается. Если соседи с двух сторон, то форма траектории становится похожа на треугольник с закругленными углами. Соседние лепестки слипаются, если в месте слипания направления движения электронов совпадают. Связанные друг с другом слипшиеся лепестки сильно укорачиваются и уже не способны менять форму и удлиняться при одном и том же уровне энергии. При этом вероятность соприкосновения с электронным лепестком другого атома становится незначительной. Изменение длины лепестка становится возможным только при изменении энергии электрона.

Рис. 4. Форма траектории электрона в связанном электронном лепестке
12 В данной модели процесс излучения атомом кванта света нагляднее всего изобразить на связанном лепестке. На рисунке ниже красным светом изображена траектория электрона до излучения. После механического внешнего воздействия на атом электрон получает дополнительный внешний импульс, который вынуждает электрон перейти на траекторию, изображенную синим цветом (после некоторого времени переходных процессов). На этой траектории электрон начинает формировать новый электронный лепесток. Достаточно большая часть новой траектории совпадает с частью старой траектории, поэтому новому лепестку сразу же достается в наследство основание старого лепестка. У остатка старого лепестка остается момент вращения, под воздействием которого он вынужден свернуться в самодвижущийся вихрь. В общем случае вихрь должен иметь форму вытянутого бублика. Чем больше разница в энергетических уровнях до и после излучения, тем больше масса осколка оболочки – тем больше энергия кванта света. Процесс излучения является следствием и начинается только после перехода электрона на новую орбиту, а не во время перехода. При излучении кванта света атом теряет часть оболочки одного из электронных лепестков, а импульса отдачи не получает. Сформированный самодвижущийся квант улетает от атома по касательной к нему. При такой интерпретации квант света не имеет ничего общего с электромагнитными волнами. У него нельзя измерить ни частоту, ни период. Можно измерить только энергию кванта и направление вытянутости (поляризацию). Процесс поглощения атомом кванта должен происходить в обратной последовательности, изображенной на рисунке. Подлетевший квант света сталкивается с электронным лепестком синего цвета, упирается в него, передает свой импульс, останавливается и начинает с ним взаимодействовать. Устойчивость электронной оболочки поддерживается вращением электрона. Поэтому первым не выдерживает квант света и начинает разрушаться. Вся его масса и момент вращения достается электронному лепестку. Формируется новый электронный лепесток красного цвета, который утягивает на новую орбиту и электрон.
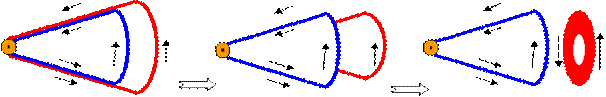
Рис.5. Излучение атомом кванта света
13 Величина дефекта массы ядра атома является суммой дефекта массы каждого нуклона ядра. При увеличении количества нуклонов все нуклоны уменьшаются в размерах и теряют массу, в том числе и протоны. Это означает, что в атоме меняются механические свойства каждой двойной механической системы протон-электрон. Следствием этого является смещение спектров излучения атомов при увеличении количества нуклонов.
14 Стабильным ядро может быть только тогда, когда все нейтроны находятся внутри ядра, когда экваторы всех нейтронов защищены от внешних воздействий, а электрон, вращающийся по экваториальной ложбине, заперт и физически не способен покинуть нейтрон. На окраинах стабильного ядра находятся только протоны, а электроны, механически связанные с ними джетами, образуют электронную оболочку атома. В отсутствие внешних воздействий большая часть нуклонов в ядре, как в кристалле, механически связаны друг с другом и не двигаются. Единственным исключением являются входящие в состав ядра He4 и их производные формы – у них вращаются протоны. Ядра атомов под непрерывным внешним воздействием со всех сторон вынуждены принимать наиболее вероятную компактную форму, близкую к форме сферы.
15 Механистическая модель строения ядер атомов позволяет вернуть спину первоначальный механический смысл. Общий спин ядра известной конфигурации вычисляется по законам механики как сумма механических моментов вращения всех составляющих ядро нуклонов с учетом знака спина. Спин нуклона – механический момент вращения. Его величина зависит от скорости вращения нуклона вокруг собственной оси и от расстояния до оси измерения, чаще всего являющейся и осью симметрии ядра. Так как собственное вращение нуклона постоянно, то изменяться может только расстояние до оси измерения.
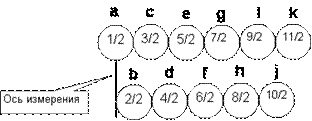

Рисунок 6. Спин нуклона в зависимости от расстояния до оси
Для точного подсчета спина ядра достаточно знать точное расстояние от каждого нуклона до оси симметрии и ориентацию спина нуклона. Четность ядра известной конфигурации можно вычислить по определению четности путем замены полярности координат и сохранения направления спинов нуклонов. Так как нет надежного способа экспериментального измерения четности, то и пользоваться справочными данными четности ядер не будем – эти данные не экспериментальные, а теоретически получены одной из ядерных моделей.
16 Теоретически возможные конфигурации ядер атомов начнем рассматривать с ядра атома гелия, которым заканчивается первый период таблицы Менделеева (He4). Попробуем подобрать конфигурацию из 2 протонов и нейтронов, которая бы удовлетворяла экспериментальным данным для основного состояния ядра гелия. Несколько теоретически возможных комбинаций показано на рисунке ниже.

Рис.7. Теоретически возможные комбинации группы из 2 протонов и 2 нейтронов
Линейная комбинация нуклонов с однонаправленными спинами (1), слипшихся полюсами, не подходит однозначно (спин=2). У линейной комбинации нуклонов, слипшихся экваторами (2), значение спина совпадает с экспериментальным значением (спин=0). Но, судя по экспериментальному значению квадрупольного момента, форма ядра должна быть близка к форме сферы. К тому же, такая линейная форма является неустойчивой конфигурацией. Любое внешнее воздействие легко может привести к перегибу ядра. В этом случае крайние нуклоны сближаются и по законам взаимодействия вихрей слипаются. Возникает третья форма (3), которая совпадает с экспериментальными данными и по значению спина и по компактной форме ядра. Но в такой конфигурации нейтроны защищены от внешних воздействий только с одной стороны. Более защищены нейтроны в четвертой конфигурации (4), которая отличается от третьей только тем, что протоны располагаются не рядом, а напротив друг друга от центра. Такая конфигурация интересна тем, что обладает максимально возможной средней энергией связи на нуклон. Она является отличной моделью альфа-частицы. Но моделью ядра обычного атома гелия быть не может. Дело в том, что атомы гелия в нормальных условиях являются химически инертными. Но электронным лепесткам, образованным ядром данной конфигурации, ничего не мешает слипаться с электронными лепестками других атомов. По мнению автора, наилучшим кандидатом на модель ядра гелия является пятая конфигурация (5). В ее центре находится нуклонная ось из двух нейтронов, слипшихся полюсами. Два протона вращаются вокруг оси по законам взаимодействия вихрей. Ядро He4 в неизменном виде может быть составной частью более сложного ядра атома.

Рис.8. Вид атома He4 и вид его ядра сверху, сбоку и снизу
17 Так как в ядре He4 протоны вращаются, то вращаются и связанные с ними электронные лепестки. А слипаться с электронными лепестками других атомов способны только стационарные лепестки. Поэтому гелий такой конфигурации инертен и не вступает в химические реакции. В данном примере показана первая причина инертности атома. Следующим инертным атомом мог бы быть Be8 с плоским ядром.

Рис.9. Плоское ядро Be8 и траектории электронов в атоме Be8
В таком ядре все нуклоны находятся в одной плоскости, 4 нейтрона в виде кольца сосредоточены внутри ядра, а протоны равномерно расположены вокруг кольца. Траектории электронов атома имеют вид четырехлепестковой ромашки. Слипшиеся друг с другом лепестки не могут вытягиваться навстречу лепесткам других атомов и слипаться с ними. Поэтому такой атом является инертным. В данном примере приведена вторая причина инертности атома. В таком виде атом мог бы просуществовать бесконечно долго, если бы отсутствовали внешние воздействия. Но плоское ядро не является компактной формой и рано или поздно в результате внешних воздействий превращается в симбиоз двух ядер гелия, слипшихся полюсами. А в таком виде между протонами возникает кулоновское взаимодействие, которое разваливает ядро пополам. Плоская форма ядра Be8 в неизменном виде может быть составной частью более сложного ядра атома.
18 Изомерным состояниям атомов, открытым у большинства изотопов, данная модель дает право на физическую независимость. Изомерные состояния теоретически возможны для всех изотопов, начиная с дейтерия. Разные изомеры одного и того же изотопа, могут иметь разные физические свойства - на примере изотопа Be8 было показано, что два изомера имеют разное время жизни. Мало того, они могут иметь и разные химические свойства – например, один может быть более химически активным, другой менее химически активным, а третий инертным. В современных же базах данных приводятся только списки с некоторыми физическими параметрами изомерных состояний конкретного изотопа, но до идентификации разницы в химических свойствах еще дело не дошло.
19 Любое измерение параметров атомов осуществляется методом физического воздействия на атомы и получения отклика атома на это воздействие. При этом вполне возможно, что массу измеряют у одного изомера, спин измеряют у другого изомера, квадрупольный момент измеряют у третьего изомера, а все данные присваивают четвертому – основному изомеру. Для идентификации атомов предлагается более расширенная их классификация путем увеличения размерности таблицы Менделеева. Первый уровень классификации – химический элемент. Это группа атомов с одинаковым количеством протонов в ядре, которое измеряется экспериментально. Имеются методы физического разделения. Второй уровень классификации – изотоп. Это группа атомов с одинаковым количеством протонов и нейтронов в ядре. Измеряется экспериментально, имеются методы физического разделения. Третий уровень классификации – изоспин. Это группа атомов с одинаковым количеством протонов и нейтронов в ядре и одинаковым значением спина ядра. Измеряется экспериментально, но методы физического разделения несовершенны. Четвертый уровень классификации – изомер. Это группа атомов с одинаковым количеством протонов и нейтронов в ядре и одинаковым их расположением в ядре, которые обладают полностью одинаковыми физическими и химическими свойствами. Экспериментальные методы определения в зачаточном состоянии, методов физического разделения вообще не существует. Названия дополнительных уровней классификации новыми не являются и уже давно совместно используются для идентификации временных состояний атомов. Новым является лишь предложение официально оформить классификацию.
20 В данной модели ядра атомов обладают как свойствами кристалла (в периоды между внешними воздействиями), так и свойствами капли жидкости (во время сильных внешних воздействий). Например, плоская форма ядра Be8, где все нуклоны жестко соединены друг с другом механическими связями, обладает кристаллическими свойствами - все нуклоны жестко сидят на своих местах, определенных структурой кристаллической решетки. Но до поры до времени. До получения сильного внешнего толчка. Сильный толчок разрушает все связи. Нуклоны смешиваются в кучу, и ядро приобретает свойства капли жидкости. Капля обладает способностью к колебаниям формы, при которых может даже поделиться пополам. Внутри капли нуклоны имеют возможность поворота, смещения, разрыва старых связей и формирования новых связей. После прекращения всех колебаний, ядро опять приобретает свойства кристалла, если не сформируются ядра He4.
21 Согласно данной модели, в условиях отсутствия внешних воздействий большая часть ядер находится в инертном состоянии. Косвенным доказательством данного утверждения является факт того, что большая часть химических реакций начинается только после нагревания, толчка, встряски, громкого звука, ввода катализатора. Посредством того или иного возбуждения ядра атомов перегруппировываются. Чем больше внешних воздействий на атом и его ядро, тем более высокая вероятность перегруппировки в валентное состояние. Для изотопа С12, например, инертных состояний может быть не менее трех. На рисунке ниже показаны три изомера, крайний справа имеет плоскую форму. Плоская форма ядра C12 в неизменном виде может быть составной частью более сложного ядра атома. В таком плоском ядре все нуклоны находятся в одной плоскости, 6 нейтронов в виде кольца сосредоточены внутри ядра, а протоны равномерно расположены вокруг кольца. Траектории электронов атома имеют вид шестилепестковой ромашки.
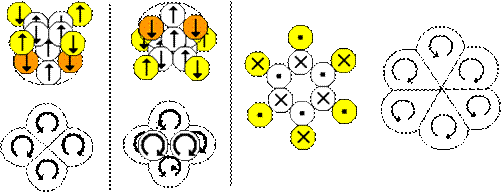
Рис.10. Форма ядер и атомов трех инертных изомеров C12
22 В рассмотренных выше ядрах кулоновское взаимодействие протонов отсутствует совсем. В них не бывает моментов, чтобы торцы двух протонов были направлены друг на друга. В данных случаях изоляция кулоновского взаимодействия осуществляется с помощью пространственного разделения протонов и устранения возможности нахождения на одной линии осей вращения протонов. Другим принципом изоляции кулоновского взаимодействия является экранирование протонов друг от друга нейтронами. Данный вид изоляции показан на рисунке ниже слева и в середине. Здесь два ядра He4 изолированы друг от друга плоскими формами ядер Be8 и С12. Третьим типом изоляции кулоновского взаимодействия является изоляция одинаковых плоских нуклонных слоев полностью заполненными слоями другого типа. Пример приведен на рисунке ниже справа. В этом случае изоляторами кулоновского взаимодействия между протонами разных плоских слоев Be8 являются не нейтроны, а электронная оболочка изолирующего нуклонного слоя He4.
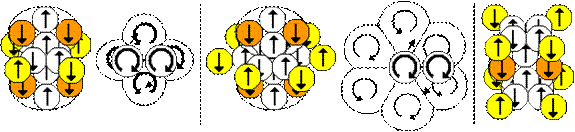
Рис.11. Форма ядер и атомов изомеров O16 и Ne20
23 В ядре He4 вокруг нейтронной оси разместить третий протон очень сложно. Он просто не успеет прилипнуть, потому что во время попытки прилипания вращающиеся протоны вышибут его. В плоских вариантах Be8 и C12 еще одну нуклонную пару тоже нельзя воткнуть – в кольцо могут слипнуться только четное количество нейтронов, так как слипание происходит только при разном направлении спинов соседних нуклонов. Таким образом, перечисленные структуры являются полностью заполненными ядерными слоями (оболочками) с количеством протонов 2, 4, 6. В данной модели ядерные оболочки физически разделены и располагаются на одной вертикальной оси в виде пирамиды. Именно поэтому данную модель можно назвать пирамидной. Ядерную пирамиду легко можно представить в виде формулы. Например, графическое изображение показанного выше ядра O16 можно закодировать следующим образом: He4-Be8-He4. Формула одного ядра-изомера атома Ne20: He4-C12-He4, формула другого: Be8-He4-Be8. Нейтроны являются только вспомогательными элементами ядерных оболочек. Один нейтрон может покинуть ядро He4, а в середине плоского варианта C12 может укрыться лишний нейтрон. В обоих случаях химические свойства атомов не изменятся. Будем считать, что ядру, как капле жидкости, наиболее присущи структуры ядерных оболочек с максимально плотной упаковкой. Приведем структуру еще нескольких оболочек с максимально плотной упаковкой. В кольце из 8 нейтронов могут разместиться еще дополнительно 2 нейтрона, если кольцо деформируется. Плоский изомер O18 имеет несимметричную форму, поэтому его существование теоретически возможно, но маловероятно. В кольце из 10 нейтронов может дополнительно разместиться кольцо из 4 нейтронов. В кольце из 12 нейтронов может дополнительно разместиться кольцо из 6 нейтронов. Кольцо из 10 нейтронов точно входит в кольцо из 16 нейтронов. Кольцо из 12 нейтронов точно входит в кольцо из 18 нейтронов. Полные оболочки с максимально возможной упаковкой нуклонов можно обозначить как плоские изомеры ядер O18, Ne24, Mg30, S46, Ar54. Их вид показан на рисунке ниже.
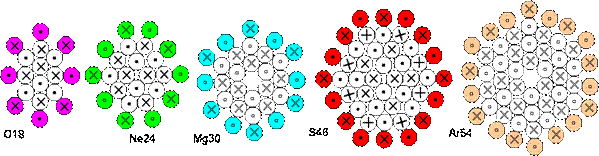
Рис.12. Форма ядер плоских изомеров O18, Ne24, Mg30, S46,Ar54
24 Одну и ту же стабильную пространственную конфигурацию протонов нейтронный каркас может одинаково поддерживать с разным количеством нейтронов. Соответственно, в этом случае и у атомов не изменяется состояние электронной оболочки. В ядрах He3 и He4 каркас представляет собой нейтронную ось из одного или двух нейтронов. В плоских изомерах ядер C12 и C13 каркас представляет собой кольцо из 6 нейтронов, в отверстии которого может присутствовать или отсутствовать один нейтрон. В плоских изомерах ядер Ne20, Ne21, Ne22, Ne23 и Ne24 каркас представляет собой кольцо из 10 нейтронов, в отверстии которого может присутствовать или отсутствовать от одного до четырех нейтронов. При малых порядковых номерах химических элементов количество нейтронов и протонов в ядре стабильных изотопов обычно совпадает. Из-за особенностей построения каркаса с повышением порядкового номера химического элемента увеличивается возможность размещения внутри ядра большего количества дополнительных нейтронов, соответственно увеличивается количество долгоживущих изотопов.
25 Валентный электронный лепесток атома механически связан с одним из протонов ядра. Расположение протона сразу после осевого нейтрона приводит к его вращению (нуклонный слой He4), поэтому валентный протон, как минимум, должен располагаться на шаг дальше от оси ядра. То есть, было бы гораздо точнее сказать, что валентный электронный лепесток атома механически связан с парой нейтрон-протон в ядре атома. Теоретически ядра химически активных атомов можно представить в виде нескольких рядов. Первый ряд, изображенный на рисунке ниже, можно выразить в виде следующих формул: None-H3a, None-He5a, None-Li7a, None-Li8a, None-Li9a, None-Be9a, где None – инертная часть ядра, оканчивающаяся нуклонным слоем He4, в крайнем случае слоем Be8, но никак не слоем C12 (в этом случае возникнет кулоновское отталкивание). В данной модели валентность атома напрямую связана с количеством электронных лепестков, жестко связанных с парой нейтрон-протон, слипшейся с осевым нейтроном. Каждый электронный лепесток имеет две степени свободы. Во-первых, он может поворачиваться вокруг осевого нейтрона. Во-вторых, он может поворачиваться к оси симметрии в соответствии с внешними условиями (например, согласно параметрам кристаллической решетки).
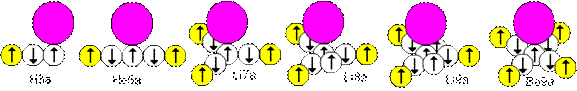
Рис.13. Односторонний ряд ядер атомов с положительной валентностью
Примеры односторонних ядер одновалентных атомов: Li7(He4-H3a), B11(Be8-H3a), N15(He4-Be8-H3a), F19(He4-Be8-He4-H3a), Na23(Be8-He4-Be8-H3a), Al27(C12-He4-Be8-H3a), P31(He4-C12-He4-Be8-H3a), Cl35(C12-He4-C12-He4-H3a), K39(Be8-He4-C12-He4-Be8-H3a). Примеры односторонних ядер двухвалентных атомов: Be9(He4-He5a), C13(Be8-He5a), O17(He4-Be8-He5a), Ne21(He4-Be8-He4-He5a), Mg25(Be8-He4-Be8-He5a), Si29(C12-He4-Be8-He5a), S33(He4-C12-He4-Be8-He5a), Ar37(C12-He4-C12-He4-He5a), Ca41(Be8-He4-C12-He4-Be8-He5a). Примеры односторонних ядер трехвалентных атомов: B11(He4-Li7a), N15(Be8-Li7a), F19(He4-Be8-Li7a), Na23(He4-Be8-He4-Li7a), Al27(Be8-He4-Be8-Li7a), P31(C12-He4-Be8-Li7a), Cl35(He4-C12-He4-Be8-Li7a), K39(C12-He4-C12-He4-Li7a), Sc43(Be8-He4-C12-He4-Be8-Li7a). Примеры односторонних ядер четырехвалентных атомов: C13(He4-Be9a), O17(Be8-Be9a), Ne21(He4-Be8-Be9a), Mg25(He4-Be8-He4-Be9a), Si29(Be8-He4-Be8-Be9a), S33(C12-He4-Be8-Be9a), Ar37(He4-C12-He4-Be8-Be9a), Ca41(C12-He4-C12-He4-Be9a). Если у первого ряда все валентные протоны находятся только с одной стороны инертной части ядра, то у другого ряда валентные протоны одновременно находятся с обеих сторон инертной части ядра. Тогда второй ряд можно выразить в виде следующих формул: H3a-None-H3a, H3a-None-He5a, He5a-None-He5a, Li7a-None-H3a, Li7a-None-He5a, Li7a-None-Li7a, H3a-None-Be9a, He5a-None-Be9a, Li7a-None-Be9a, Be9a-None-Be9a. Примеры двухсторонних ядер двухвалентных атомов: Be10(H3a-He4-H3a), C14(H3a-Be8-H3a), O18(H3a-He4-Be8-H3a), Ne22(H3a-He4-Be8-He4-H3a), Mg26(H3a-Be8-He4-Be8-H3a). Примеры двухсторонних ядер трехвалентных атомов: B12(H3a-He4-He5a), N16(H3a-Be8-He5a), F20(H3a-He4-Be8-He5a), Na24(H3a-He4-Be8-He4-He5a), Al28(H3a-Be8-He4-Be8-He5a), P32(H3a-Be8-He4-Be8-He4-He5a), Cl36(H3a-Be8-He4-C12-He4-He5a), K40(H3a-He4-Be8-He4-C12-He4-He5a). Примеры двухсторонних ядер четырехвалентных атомов: С14(He5a-He4-He5a), O18(He5a-Be8-He5a), Ne22(He5a-He4-Be8-He5a), Mg26(He5a-He4-Be8-He4-He5a), Si30(He5a-Be8-He4-Be8-He5a), S34(He5a-Be8-He4-Be8-He4-He5a), Ar38(He5a-Be8-He4-C12-He4-He5a), Ca42(He5a-He4-Be8-He4-C12-He4-He5a). Примеры двухсторонних ядер пятивалентных атомов: N16(He5a-He4-Li7a), F20(He5a-Be8-Li7a), Na24(He5a-He4-Be8-Li7a), Al28(He5a-He4-Be8-He4-Li7a), P32(He5a-Be8-He4-Be8-Li7a), Cl36(He5a-Be8-He4-Be8-He4-Li7a), K40(He5a-Be8-He4-C12-He4-Li7a), Sc44 (He5a-He4-Be8-He4-C12-He4-Li7a). Примеры двухсторонних ядер шестивалентных атомов: O18(Li7a-He4-Li7a), Ne22(Li7a-Be8-Li7a), Mg26(Li7a-He4-Be8-Li7a), Si30(Li7a-He4-Be8-He4-Li7a), S34(Li7a-Be8-He4-Be8-Li7a), Ar38(Li7a-Be8-He4-Be8-He4-Li7a), Ca42(Li7a-Be8-He4-C12-He4-Li7a), Ti46(Li7a-He4-Be8-He4-C12-He4-Li7a). Примеры двухсторонних ядер семивалентных атомов: F20(Li7a-He4-Be9a), Na24(Li7a-Be8-Be9a), Al28(Li7a-He4-Be8-Be9a), P32(Li7a-He4-Be8-He4-Be9a), Cl36(Li7a-Be8-He4-Be8-Be9a), K40(Li7a-Be8-He4-Be8-He4-Be9a), Sc44(Li7a-Be8-He4-C12-He4-Be9a). Примеры ядер восьмивалентных атомов: Ne22(Be9a-He4-Be9a), Mg26(Be9a-Be8-Be9a), Si30(Be9a-He4-Be8-Be9a), S34(Be9a-He4-Be8-He4-Be9a), Ar38(Be9a-Be8-He4-Be8-Be9a), Ca42(Be9a-Be8-He4-Be8-He4-Be9a), Ti46(Be9a-Be8-He4-C12-He4-Be9a). Существование семивалентных и восьмивалентных атомов маловероятно, но в данной модели теоретически возможно.
26 Если инертная часть ядра оканчивается слоем He4, то наличие осевого нейтрона необязательно, потому что валентные пары нейтрон-протон вполне могут прилипнуть к торчащей половине торцевого нейтрона нуклонного слоя He4. Такой односторонний ряд можно выразить в виде следующих формул: None-1хH2, None-2хH2, None-3хH2, None-4хH2. Вид формул для двухстороннего ряда: 1хH2-None-1хH2, 1хH2-None-2хH2, 1хH2-None-3хH2, 1хH2-None-4хH2, 2хH2-None-2хH2, 2хH2-None-3хH2, 2хH2-None-4хH2, 3хH2-None-3хH2, 3хH2-None-4хH2, 4хH2-None-4хH2.
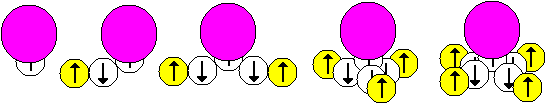
Рис.14. Вид ядер без осевого нейтрона у атомов с положительной валентностью
Примеры односторонних ядер одновалентных атомов: H2, Li6(He4-1хH2), N14(Be8-He4-1хH2), F18(He4-Be8-He4-1хH2), Na22(He4-C12-He4-1хH2), Al26(Be8-He4-Be8-He4-1хH2), P30(C12-He4-Be8-He4-1хH2), Cl34(C12-He4-C12-He4-1хH2), K38(Be8-He4-Be8-He4-Be8-He4-1хH2). Примеры односторонних ядер двухвалентных атомов: Be8(He4-2хH2), O16(Be8-He4-2хH2), Ne20(He4-Be8-He4-2хH2), Mg24(He4-C12-He4-2хH2), Si28(Be8-He4-Be8-He4-2хH2), S32(C12-He4-Be8-He4-2хH2), Ar36(C12-He4-C12-He4-2хH2), Ca40(He4-C12-He4-C12-He4-2хH2). Примеры односторонних ядер трехвалентных атомов: B10(He4-3хH2), F18(Be8-He4-3хH2), Na22(He4-Be8-He4-3хH2), Al26(He4-C12-He4-3хH2), P30(Be8-He4-Be8-He4-3хH2), Cl34(C12-He4-Be8-He4-3хH2), K38(C12-He4-C12-He4-3хH2), Sc42(He4-C12-He4-C12-He4-3хH2). Примеры односторонних ядер четырехвалентных атомов: C12(He4-4хH2), Ne20(Be8-He4-4хH2), Mg24(He4-Be8-He4-4хH2), Si28(He4-C12-He4-4хH2), S32(Be8-He4-Be8-He4-4хH2), Ar36(C12-He4-Be8-He4-4хH2), Ca40(C12-He4-C12-He4-4хH2), Ti44(He4-C12-He4-C12-He4-4хH2).
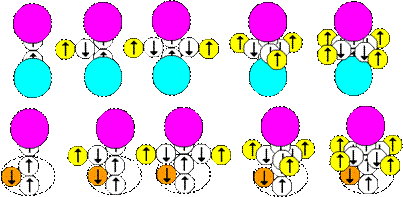
Рис.15. Двуцентровой ряд, общий вид сверху, частный случай снизу
Теоретически рассмотрим еще одну ситуацию. В ряду ядер химически активных атомов, изображенном на рисунке выше, не один, а два центра, две инертных части, валентные пары нейтрон-протон располагаются между ними. Каждая инертная часть оканчивается торцевым нейтроном. Этими нейтронами и соединяются две инертные части. Каждая валентная пара нейтрон-протон здесь прилипает к месту соединения нейтронов, поэтому дополнительный осевой нейтрон в данном ряду не нужен. Ряд можно выразить в виде следующих формул: None1-1xH2-None2, None1-2xH2-None2, None1-3xH2-None2, None1-4xH2-None2, где None1 и None2 являются инертными частями. На рисунке изображен частный случай ряда, в котором инертная часть None2 представлена группой из трех нуклонов, которую обозначим как H3b. Примеры двуцентровых ядер одновалентных атомов: Li8(H3b-1xH2-H3b),Be9(He4-1xH2-H3b),B10(He4-1xH2-He4), O17(Be8-He4-1xH2-H3b), F18(Be8-He4-1xH2-He4), Mg25(Be8-He4-1xH2-H3b-Be8), Al26(Be8-He4-1xH2-He4-Be8), P30(C12-He4-1xH2-He4-Be8), Cl34(C12-He4-1xH2-He4-C12), K38(He4-C12-He4-1xH2-He4-C12), Sc42(He4-C12-He4-1xH2-He4-C12-He4). Примеры двуцентровых ядер двухвалентных атомов: B11(He4-2xH2-H3b), C12(He4-2xH2-He4), O18(Be8-H3b-2xH2-H3b), F19(Be8-He4-2xH2-H3b), Ne20(Be8-He4-2xH2-He4), Si28(Be8-He4-2xH2-He4-Be8), S32(C12-He4-2xH2-He4-Be8), Ar36(C12-He4-2xH2-He4-C12), Ca40(He4-C12-He4-2xH2-He4-C12), Ti44 (He4-C12-He4-2xH2-He4-C12-He4). Примеры двуцентровых ядер трехвалентных атомов: B12(H3b-3xH2-H3b), C13(He4-3xH2-H3b), N14(He4-3xH2-He4), Na22(Be8-He4-3xH2-He4), P30(Be8-He4-3xH2-He4-Be8), Cl34(C12-He4-3xH2-He4-Be8), K38(C12-He4-3xH2-He4-C12), Sc42(He4-C12-He4-3xH2-He4-C12), V46 (He4-C12-He4-3xH2-He4-C12-He4). Примеры двуцентровых ядер четырехвалентных атомов: N15(He4-4xH2-H3b), O16(He4-4xH2-He4), Mg24(Be8-He4-4xH2-He4), S32(Be8-He4-4xH2-He4-Be8), Ar36(C12-He4-4xH2-He4-Be8), Ca40(C12-He4-4xH2-He4-C12), Ti44(He4-C12-He4-4xH2-He4-C12), Cr48 (He4-C12-He4-4xH2-He4-C12-He4).
27 Были рассмотрены ядра химически активных атомов с положительной валентностью. У них каждый валентный электронный лепесток вытягивается из атома для слипания с другим атомом. Атомы с отрицательной валентностью наоборот, втягивают во внутрь собственного ядра электронные лепестки других атомов. Некоторые односторонние ядра атомов с отрицательной валентностью можно выразить в виде следующих формул: None-B11m, None-Be10m, None-B10m, None-Be9m. Здесь в центре валентного слоя находится кольцо из шести нейтронов, одетое на половинку осевого нейтрона из инертной части.
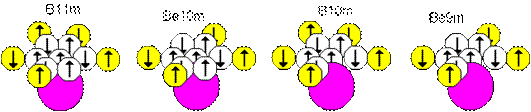
Рис.16. Ряд ядер атомов с отрицательной валентностью без осевого нейтрона
Атомы ядер, изображенные на рисунке выше, валентных лепестков не имеют вообще. Зато они имеют лепестковые вакансии, которые способны по правилам взаимодействия вихрей втягивать электронные лепестки других атомов. Примеры ядер атомов первой конфигурации: N15(He4-B11m), Na23(Be8-He4-B11m), Al27(C12-He4-B11m), P31(He4-C12-He4-B11m), Cl35(Be8-He4-Be8-He4-B11m), K39(C12-He4-Be8-He4-B11m). Двусторонний вариант: Mg26(B11m-He4-B11m), Ar38(B11m-He4-Be8-He4-B11m), Ca42(B11m-He4-C12-He4-B11m). Двуцентровой вариант: F19(He4-B11m-He4), Al27(Be8-He4-B11m-He4), P31(He4-Be8-He4-B11m-He4), Cl35(Be8-He4-B11m-He4-Be8), K39(C12-He4-B11m-He4-Be8), Sc43(C12-He4-B11m-He4-C12), V47(C12-He4-B11m-He4-C12-He4), Mn51(He4-C12-He4-B11m-He4-C12-He4). Примеры ядер атомов второй конфигурации: C14(He4-Be10m), Ne22(Be8-He4-Be10m), Mg26(C12-He4-Be10m), Si30(He4-C12-He4-Be10m), S34(Be8-He4-Be8-He4-Be10m), Ar38(C12-He4-Be8-He4-Be10m). Двусторонний вариант: Ne24(Be10m-He4-Be10m), S36(Be10m-He4-Be8-He4-Be10m), Ar40(Be10m-He4-C12-He4-Be10m). Двуцентровой вариант: O18(He4-Be10m-He4), Mg26(Be8-He4-Be10m-He4), Si30(He4-Be8-He4-Be10m-He4), S34(Be8-He4-Be10m-He4-Be8), Ar38(He4-Be8-He4-Be10m-He4-Be8), Ca42(C12-He4-Be10m-He4-C12), Ti46(C12-He4-Be10m-He4-C12-He4), Cr50(He4-C12-He4-Be10m-He4-C12-He4).
28 Теоретически возможны конфигурации ядер и со смешанной валентностью, если в них присутствуют плоские слои Be10w,Be9w,Be8w, показанные на рисунке ниже.
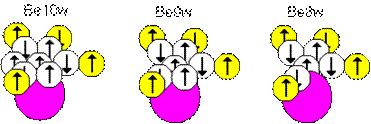
Рис.17. Ряд ядер атомов со смешанной валентностью без осевого нейтрона
Атомы с такими ядрами в разных условиях могут быть либо положительно одновалентным либо отрицательно двухвалентным. Теоретически возможны и двусторонние варианты и двуцентровые варианты.
29 Рассмотренные выше варианты валентных слоев подразделяются на две группы: с осевым нейтроном и без осевого нейтрона. В ядрах с валентными нуклонными слоями без осевого нейтрона обычно все нейтроны полностью защищены от внешних воздействий либо протонами, либо электронными лепестками соседних протонов.
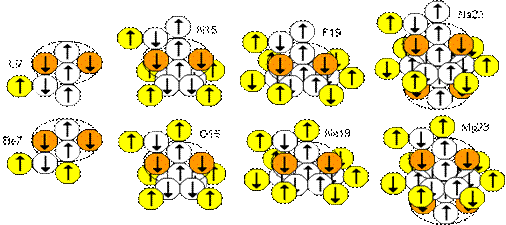
Рис.18. Примеры зеркальных ядер
В ядрах же с осевым нейтроном в конфигурациях, когда инертная часть ядра оканчивается слоем He4, самый крайний осевой нейтрон защищен только наполовину. В результате внешних воздействий такой нейтрон может превратиться в протон. Пространственная структура ядра не меняется, но атом становится изотопом совсем другого химического элемента. Такие пары ядер атомов с одинаковой пространственной структурой нуклонов, но с разным соотношением протонов и нейтронов, называются зеркальными. На рисунке выше изображено 4 зеркальных пары: Li7|Be7, N15|O15, F19|Ne19, Na23|Mg23.
30 Атом не в состоянии участвовать в химических реакциях, если его ядро находится в инертном состоянии. Инертное состояние ядра является следствием инертного состояния всех его нуклонных слоев (оболочек). Нуклонная оболочка может быть инертной только в двух случаях: либо она является полностью заполненной, либо она заполнена частично, но не имеет возможностей для создания свободных электронных лепестков или свободных электронных вакансий. Так, если в частично заполненной оболочке He4 отсутствует один нейтрон (He3), то все равно оболочка не станет валентной, потому что протоны будут продолжать вращаться вокруг нейтронной оси. Если в частично заполненной оболочке He4 отсутствует один протон (H3b), то все равно оболочка не станет валентной, потому что оставшийся один протон будет продолжать вращаться вокруг нейтронной оси. Если в отверстии полностью заполненной оболочки С12 или Mg30 находится дополнительный нейтрон, то оболочка не станет валентной. Если в оболочке С12 отсутствуют два протона подряд, то такая оболочка не станет валентной. Обозначим такую оболочку как Be10i, в отличие от валентной Be10. Часть теоретически возможных конструкций полностью заполненных нуклонных оболочек была уже рассмотрена выше: He4, плоские состояния Be8, C12, Ne24, Mg30, S46, Ar54. Удельная энергия связи перестает увеличиваться в области железа-никеля после изотопа Ni62.
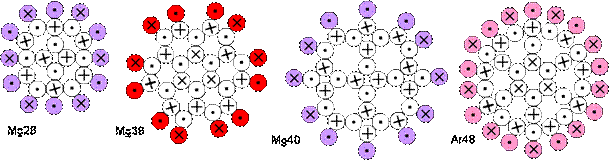
Рис.19. Форма ядер плоских изомеров с редкой упаковкой
Такой факт приводит к мысли, что в этой области в конфигурации ядер начинают использоваться ядерные плоские слои без максимальной упаковки. Возможный вид таких слоев показан на рисунке выше. Меньшая плотность нуклонов здесь компенсируется дополнительными связями между нейтронами.
31 Внутри любого ядерного плоского слоя находится либо кольцо из четырех нейтронов либо кольцо из шести нейтронов. Отверстие внутри этих колец дает возможность зафиксировать весь плоский слой внутри ядра. В отверстие кольца из шести нейтронов осевой нейтрон может пройти целиком. В отверстие кольца из четырех нейтронов может зайти только половинка осевого нейтрона. Рассмотрим для примера конфигурацию ядерного изомера Ar36(He4-Be8-C12-Be8-He4). Внешнее воздействие на ядро со стороны торцов, параллельное оси симметрии ядра, имеет мало шансов развалить ядро. Если толчок внешнего воздействия получает любой из протонов слоя He4, то протон упрется в нейтронное кольцо слоя Be8 и не сможет покинуть ядро. Аналогичный процесс произойдет при воздействии на внешний нейтрон слоя He4. Таким образом, любое воздействие на ядро со стороны его торца приводит только к передаче импульса всему ядру. Результатом внешнего воздействия будет перемещение в пространстве всего ядра. Единственным исключением может быть случай, когда в результате механических колебаний возникает резонанс, при котором большая часть внешнего импульса достается противоположному слою He4. В этом случае, если полученный импульс превышает некую критическую величину, то весь слой He4 может быть выбит из ядра (явление испускания ядром альфа-частицы). Теперь рассмотрим последствия внешних воздействий, осуществляемых на ядро перпендикулярно оси симметрии. В этом случае, если удар приходится на один из трех внешних нуклонов слоя He4, то нуклон может быть выбит из ядра (явление испускания ядром протона или нейтрона). Если удар приходится по любому нуклону слоев Be8 или C12, то произойдет распределение полученного импульса по всему плоскому слою. В этом случае при достаточной величине полученного импульса из ядра может быть выбит либо целиком весь плоский слой С12 (явление деления ядра на несколько частей), либо сцепленные комбинации He4-Be8, Be8-He4. Более устойчивым будет другой изомер Ar36(He4-C12-He4-C12-He4). В этом случае два плоских слоя C12 фиксируются в ядре нейтронной осью из 6 нейтронов. Ось из 6 нейтронов надежно зафиксирует и плоские слои в ядерном изомере Ar38(He4-Be8-n-C12-n-Be8-He4). Здесь два добавочных осевых нейтрона заполняют пустоты в плоских слоях и слипаются с осевыми нейтронами слоев He4. Внешне этот изомер ничем не отличается от изомера Ar36(He4-Be8-C12-Be8-He4), но гораздо устойчивей к внешним воздействиям.
32 Если в соседних плоских слоях соседствуют одинаковые нейтронные кольца, то они слипаются между собой по правилам взаимодействия вихрей (в месте слипания должно совпадать направление вращения стенок вихрей). Для примера рассмотрим ядерный изомер Ar40(Be8-Ne24-Be8). Здесь у всех трех плоских слоев имеется внутреннее кольцо из четырех нейтронов. Этими кольцами все три слоя надежно слипаются между собой без какой-либо нейтронной оси. В этом ядре можно еще разместить два нейтрона. При этом одна половинка каждого нейтрона размещается в отверстии слоя Be8, а другая половинка размещается в отверстии слоя Ne24. Пример ядeр покрупнее: Cd118(He4-Be8-Ne24-S46-Ne24-Be8-He4), Te126(He4-Be8-Mg28-S46-Mg28-Be8-He4). Аналогичное слипание должно происходить и в том случае, если в соседних плоских слоях имеется внутреннее кольцо из шести нейтронов. Несколько примеров подобных ядер: Ni62(He4-C12-Mg30-C12-He4), Ce144(He4-C12-Mg30-Ar48-Mg30-C12-He4).
33 Попробуем сравнить вероятность существования ядра в разных изомерных состояниях на примере ядра изотопа 36Kr88. Сначала составим краткий перечень теоретически возможных состояний: 1-(C12-Be8-Ar48-Be8-C12), 2-(Be8-C12-Ar48-C12-Be8), 3-(He4-C12-Ar48-C12-He4-Be8), 4-(He4-C12-He4-Ar48-He4-C12-He4), 5-(Be8-He4-Be8-He4-Ar48-He4-Be8-He4), 6-(Be8-Mg30-C12-Mg30-Be8), 7-(C12-Mg30-He4-Mg30-C12), 8-(He4-Mg30-C12-Mg30-He4-Be8), 9-(Be8-He4-Mg30-He4-Mg30-He4-Be8), 10-(C12-n-Mg30-n-C12-Ne24-Be8), 11-(He4-C12-n-Mg30-n-Be8-Ne24-Be8), 12-(He4-C12-n-Mg30-n-Ne24-He4-Be8-He4), 13-(He4-C12-n-Mg30-He4-Ne24-n-Be8-He4), 14-(Be8-n-Mg28-n-C12-n-Mg28-n-Be8), 15-(C12-n-Mg28-n-C12-n-Ne24-n-Be8), 16-(He4-C12-n-Mg28-n-Be8-n-Ne24-n-Be8), 17-(He4-Be8-n-Mg28-n-Be8-n-Ne24-n-Be8-He4), 18-(C12-n-Ne24-n-C12-n-Ne24-n-C12), 19-(C12-n-Ne24-n-Be8-n-Ne24-n-C12-He4), 20-(He4-Be8-n-Ne24-n-C12-n-Ne24-n-Be8-He4), 21-(Be8-n-Ne24-n-Be8-n-Ne24-n-Be8-He4-Be8), 22-(Be8-n-C12-n-Mg30-n-C12-n-Be8-n-C12-n), 23-(He4-Be8-n-C12-n-Mg30-n-Be8-n-C12-n-Be8-n), 24(C12-He4-C12-Mg36-C12-He4-Be8), 25(He4-Be8-He4-C12-Mg36-C12-He4-Be8), 26(He4-Be8-He4-C12-He4-Mg36-He4-C12-He4), 27(He4-Be8-He4-Be8-He4-Mg36-He4-Be8-He4-Be8). Исходя из поведения капли при механических колебаниях, можно сделать вывод, что наиболее вероятно образование симметричных состояний: “1”, “2”, “4”, “6”, “7”, “9”, “14”, “18”, “20”. Состояния “1”, “2” и “6” менее вероятны по причине плохой защиты от внешних воздействий. В состоянии “1” пять ядерных слоев ничем не скреплены между собой. Боковое внешнее воздействие на любой слой может вышибить целиком весь этот слой из ядра. Состояние “2” более устойчиво. Здесь три средних слоя скрепляются нейтронными кольцами из 6 нейтронов. Но крайние слои по-прежнему не закреплены. Возможны два последствия бокового внешнего воздействия. В первом случае из ядра вышибается слой Be8, во втором случае ядро разваливается на три части Be8, 30Zn72(C12-Ar48-C12), Be8. Состояние “3” еще устойчивей. Здесь все соседние ядерные слои сцеплены друг с другом либо нейтронными кольцами, либо половинками осевых нейтронов от слоя He4. В состоянии “6” внешнее воздействие развалит ядро на части Be8, 30Zn72(Mg30-C12-Mg30), Be8. Состояния “2” и “6” будут устойчивы к внешним воздействиям, если, как в пирамиде, слои скрепить центральным стержнем - нейтронной осью из четырех нейтронов: 36Kr92(Be8-n-C12-n-Ar48-n-C12-n-Be8), 36Kr92 (Be8-n-Mg30-n-C12-n-Mg30-n-Be8). В состоянии “10” скрепляющий стержень имеется, но толку от него мало, потому что он имеет степень свободы и может свободно перемещаться внутри ядра. Боковое внешнее воздействие развалит ядро на две части: 24Cr56(C12-n-Mg30-n-C12), 14Si32(Ne24-Be8). Исходя из других соображений, более вероятным кажется образование состояний с максимально плотной упаковкой нуклонов: “9”, “12”, “13”, “18”, “19”, “20”, “21”, “22”, “23”. Для капли из всех симметричных состояний наиболее вероятно сферическое состояние. В нашем случае близкое к сфере состояние достигается при равенстве высоты пирамиды и диаметра наиболее широкого слоя: Ar48-9 нуклонов; Mg30-7 нуклонов; Mg28-6,5 нуклонов; Ne24-6,5 нуклонов; Mg36-9 нуклонов. Наиболее близки к сферической форме состояния: “5”-9х8,5 нуклонов, “8”-7х6,5 нуклонов, “9”-7х7 нуклонов, “11”-7х6,5 нуклонов, “12”-7х8 нуклонов, “13”-7х8 нуклонов, “16”-6,5х6,5 нуклонов, “19”-6,5х6,5 нуклонов, “21”-6,5х7 нуклонов, “22”-7х6,5 нуклонов, “25”-9х8,5 нуклонов, “26”-9х10 нуклонов. С точки зрения устойчивости к внешним воздействиям, наиболее вероятно существование состояний, в которых нет незакрепленных ядерных слоев, большинство соседних ядерных слоев скреплено нейтронными кольцами: “3”, “7”, “8”, “10”, “13”, “14”, “16”, “17 ”, “20”, “21”, “24”, “25”. По перечисленным выше критериям, наиболее вероятным является образование плотного симметричного состояния “9”, но максимальная энергия связи у ядер в состояниях “13” и “21”.
34 В данной модели основное состояние ядра – это наиболее вероятное изомерное состояние ядра свободного атома в отсутствии внешних возбуждений. В большинстве случаев изомерное состояние ядра атома, связанного в химическом соединении, не совпадает с изомерным состоянием ядра свободного атома. Физические параметры основных состояний ядер приводятся в общедоступных базах данных. Основная особенность основных состояний – спин всех четно-четных ядер равен нулю. В настоящее время все открытые изотопы принято отображать в виде двумерной таблицы, где одним измерением является количество протонов в ядре, а другим измерением – количество нейтронов. На этой таблице все долгоживущие изотопы (с временем жизни больше 1 минуты) сосредоточены в виде длинной полосы, которую называют долиной стабильности. Хотя было бы правильней назвать хребтом удельной энергии связи, состоящим из большого количества параллельных гряд с формулой ядер N=P+k, где P-количество протонов, N-количество нейтронов, k-натуральное число. На этом хребте выделяются пики сверхвысокой удельной энергии связи, которые принадлежат только ядрам с четным количеством протонов и четным количеством нейтронов. Достаточно понять принципы конфигурации четно-четных ядер. Все остальные ядра будут производными от четно-четных ядер. Причина существования пиков энергии связи у четно-четных ядер кроется в стремлении ядра в свободном состоянии приобрести максимально устойчивую форму. А форма ядра будет устойчивой только в том случае, если все ядерные слои имеют максимально устойчивую форму (He4, Be8, C12 и т.д.). Как только в ядре появляются новые два протона и два нейтрона, то вероятнее всего их группировка в альфа-частицу. Если ядро не способно изолироваться от кулоновского отталкивания альфа-частицы, то либо альфа-частица вылетает из ядра, либо в ядре должна произойти новая перегруппировка во время жидкого капельного состояния. Опустим все тонкости термоядерного синтеза. В ядре должны появиться четыре нуклона, которые после взаимопревращений превращаются в две пары протон-нейтрон. Нам не важно, каким путем четверка нуклонов появилась в новом ядре, последовательно ли, или сразу. Все промежуточные процессы опустим. Начнем мысленный синтез с ядра He4. Очередное столкновение – состояние жидкой капли – кристаллизация – плоская форма Be8. Столкновение – жидкая капля – кристаллизация – инертное состояние С12 (одна из трех форм Be8-He4, He4-Be8, плоская форма C12). Столкновение – жидкая капля – кристаллизация – инертное состояние O16(He4-Be8-He4). При таком мысленном синтезе получим последовательный ряд стабильных четно-четных ядер. Остальные члены ряда - Ne20(He4-C12-He4); Mg24(He4-Be8-He4-Be8); Si28(He4-Be8-He4-Be8-He4); S32(He4-С12-He4-Be8-He4); Ar36(He4-C12-He4-С12-He4); Ca40(He4-Be8-He4-C12-He4-Be8); Ti44(He4-Be8-He4-C12-He4-Be8-He4); Cr48(He4-Be8-He4-C12-He4-C12-He4); Fe52(He4-C12-He4-C12-He4-C12-He4); Ni56(He4-Be8-He4-C12-He4-C12-He4-Be8); Zn60(He4-Be8-He4-C12-He4-C12-He4-Be8-He4); Ge64(He4-Be8-He4-C12-He4-C12-He4-C12-He4). Здесь стабильными являются изотопы с ядром, близким к форме сферы, где диаметр ядра равен диаметру самого большого слоя C12 (5 нуклонов), а высота ядра не более 6 нуклонов. Чем больше высота ядра, тем больше форма ядра отличается от сферической формы, тем меньше время жизни изотопа.
35 Ряды с N>P формируются аналогично ряду N=P за единственным исключением – неизменной остается основа ряда. Время жизни ядер растет в начале ряда, достигает максимума в середине ряда и падает в конце ряда. Для раскрытия механизма формирования рядов достаточно показать лишь несколько примеров. Ряд долгоживущих четно-четных ядер c N=P+2 начинается с плоского ядра Be10. Остальные члены ряда: С14(Be10-He4); O18(He4-Be10-He4); Ne22(Be8-He4-Be10); Mg26(Be8-He4-Be10-He4); Si30(He4-Be8-He4-Be10-He4); S34(He4-C12-He4-Be10-He4); Ar38(Be8-He4-C12-He4-Be10); Ca42(Be8-He4-C12-He4-Be10-He4); Ti46(He4-C12-He4-C12-He4-Be10); Cr50(He4-C12-He4-C12-He4-Be10-He4); Fe54(Be8-He4-C12-He4-C12-He4-Be10); Ni58(Be8-He4-C12-He4-C12-He4-Be10-He4); Zn62(He4-C12-He4-C12-He4-C12-He4-Be10); Ge66(He4-C12-He4-C12-He4-C12-He4-Be10-He4); Se70(Be8-He4-C12-He4-C12-He4-C12-He4-Be10). Параллельно существующая линия: Si30(Be8-n-C12-n-Be8); S34(He4-Be8-n-C12-n-Be8); Ar38(He4-Be8-n-C12-n-Be8-He4); Ca42(Be8-He4-Be8-n-C12-n-Be8); Ti46(Be8-He4-Be8-n-C12-n-Be8-He4); Cr50(He4-Be8-He4-Be8-n-C12-n-Be8-He4); Fe54(He4-C12-He4-Be8-n-C12-n-Be8-He4); Ni58 (Be8-He4-C12-He4-Be8-n-C12-n-Be8); Zn62(Be8-He4-C12-He4-Be8-n-C12-n-Be8-He4); Ge66 (He4-Be8-He4-C12-He4-Be8-n-C12-n-Be8-He4); Se70(He4-C12-He4-C12-He4-Be8-n-C12-n-Be8-He4; Kr74(Be8-He4-C12-He4-C12-He4-Be8-n-C12-n-Be8); Sr78(C12-He4-C12-He4-C12-He4-Be8-n-C12-n-Be8). Ряд долгоживущих четно-четных ядер c N=P+4 начинается с плоского ядра Ne24. Остальные члены ряда: Mg28(Ne24-He4); Si32(He4-Ne24-He4); S36 (He4-Ne24-Be8); Ar40(Be8-Ne24-Be8); Ca44(Be8-Ne24-Be8-He4); Ti48(He4-Be8-Ne24-Be8-He4); Cr52(Be8-He4-Be8-Ne24-Be8); Fe56(Be8-He4-Be8-Ne24-Be8-He4); Ni60(He4-Be8-He4-Be8-Ne24-Be8-He4); Zn64(Be8-He4-Be8-Ne24-Be8-He4-Be8); Ge68(He4-Be8-He4-Be8-Ne24-Be8-He4-Be8); Se72(He4-Be8-He4-Be8-Ne24-Be8-He4-Be8-He4); Kr76(He4-C12-He4-Be8-Ne24-Be8-He4-Be8-He4); Sr80(He4-C12-He4-Be8-Ne24-Be8-He4-C12-He4); Zr84 (He4-C12-He4-Be8-Ne24-Be8-He4-Be8-He4-Be8); Mo88(He4-C12-He4-Be8-Ne24-Be8-He4-C12-He4-Be8); Ru92(Be8-He4-Be8-He4-Be8-Ne24-Be8-He4-C12-He4-Be8); Pd96(Be8-He4-C12-He4-Be8-Ne24-Be8-He4-C12-He4-Be8). Параллельно существующие линии начинаются с ядер Ne24(Be10-He4-Be10), Mg28(Be8-n-Be10-n-Be8), Ca44(Be8-Mg28-Be8), Cr52(Be8-n-C12-n-Be8-n-C12-n-Be8). Первым членом ряда ядер c N=P+6 является ядро S38(He4-Mg30-He4). Остальные члены ряда: Ar42(Mg30-He4-Be8); Ca46(He4-Mg30-He4-Be8); Ti50(He4-Mg30-C12-He4); Cr54(Be8-He4-Mg30-He4-Be8); Fe58(He4-C12-Mg30-He4-Be8); Ni62(He4-C12-Mg30-C12-He4); Zn66(He4-C12-Mg30-He4-C12-He4); Ge70(He4-C12-Mg30-C12-He4-Be8); Se74(He4-C12-Mg30-C12-He4-Be8-He4); Kr78(Be8-He4-C12-Mg30-C12-He4-Be8); Sr82(He4-Be8-He4-C12-Mg30-C12-He4-Be8); Zr86(He4-Be8-He4-C12-Mg30-C12-He4-Be8-He4); Mo90 (He4-C12-He4-C12-Mg30-C12-He4-Be8-He4); Ru94(He4-C12-He4-C12-Mg30-C12-He4-C12-He4); Pd98(He4-C12-He4-C12-Mg30-C12-He4-Be8-He4-Be8); Cd102(He4-C12-He4-C12-Mg30-C12-He4-C12-He4-Be8). Параллельно существующие линии начинаются с ядер: S38(Ne24-He4-Be10), Ar42(Be8-n-Ne24-n-Be8), Ca46(Be8-n-Mg28-n-Be8). Дальше покажем только варианты начала рядов. Одна из линий ряда ядер c N=P+8 начинается с ядра Ar44(He4-Mg30-Be10). Одна из линий ряда ядер c N=P+10 начинается с ядра Fe62(He4-Mg30-He4-Ne24). Одна из линий ряда ядер c N=P+12 начинается с ядра Zn72(Be8-He4-Ar48-He4-Be8). Одна из линий ряда ядер c N=P+14 начинается с ядра Zn74(Be8-He4-Ar48-Be10-He4). Одна из линий ряда ядер c N=P+16 начинается с ядра Se84 (He4-Ne24-He4-Ar48-He4). Одна из линий ряда ядер c N=P+18 начинается с ядра Mo102 (Be8-He4-Mg30-Ar48-He4-Be8). Одна из линий ряда ядер c N=P+20 начинается с ядра Ru108(He4-C12-Mg30-Ar48-Be10-He4). Одна из линий ряда ядер c N=P+22 начинается с ядра Pd114(He4-Mg30-Ar48-He4-Ne24-He4). Одна из линий ряда ядер c N=P+24 начинается с ядра Sn124(Be8-He4-Ar48-C12-Ar48-He4). Одна из линий ряда ядер c N=P+26 начинается с ядра Sn126(He4-Be10-Ar48-C12-Ar48-He4). Одна из линий ряда ядер c N=P+28 начинается с ядра Sn128(Be10-Mg30-Ar48-Mg30-Be10). Одна из линий ряда ядер c N=P+30 начинается с ядра Te134(He4-Ar48-Mg30-Ar48-He4). Одна из линий ряда ядер c N=P+32 начинается с ядра Nd152(Be8-S46-Ne24-S46-Be8). Одна из линий ряда ядер c N=P+34 начинается с ядра Sm158(He4-Ar48-Mg30-Ar48-He4-Ne24). Одна из линий ряда ядер c N=P+36 начинается с ядра Gd164(He4-Ar48-Mg30-Ar48-Mg30-He4). Одна из линий ряда ядер c N=P+38 начинается с ядра Er174 (He4-Ar48-C12-Ar48-Be10-Ar48-He4). Одна из линий ряда ядер c N=P+40 начинается с ядра Yb180(Be8-Ne24-S46-Ne24-S46-Ne24-Be8). Одна из линий ряда ядер c N=P+42 начинается с ядра Hf186(He4-Ar48-He4-Ar48-Mg30-Ar48-He4). Одна из линий ряда ядер c N=P+44 начинается с ядра Os196(He4-Ar48-He4-Ar48-Mg30-Ar48-Be10-He4). На этом материк долгоживущих ядер заканчивается. Дальше начинается остров долгоживущих ядер. Одна из линий ряда острова начинается с ядра U228(He4-Ne24-He4-Ar48-C12-Ar48-C12-Ar48-He4-Ne24). Одна из линий ряда ядер материка c N=P+46 начинается с ядра Pt202 (Be8-S46-Be8-S46-Be8-S46-Be8-Ne24-Be8). Одна из линий ряда острова начинается с ядра Th226(He4-Ar48-C12-Ar48-Mg30-Ar48-He4-Ne24-Be8). Одна из линий ряда ядер материка c N=P+48 начинается с ядра Hg208(Be8-He4-C12-Mg30-Ar54-Mg30-Ar54-C12-He4). Одна из линий ряда острова начинается с ядра Ra224(He4-C12-Mg30-Ar54-Mg30-Ar48-Mg30-C12-He4). Одна из линий самого последнего ряда ядер материка c N=P+50 начинается с ядра Pb214(He4-Be10-He4-C12-Mg30-Ar54-Mg30-Ar54-C12-He4). Одна из линий ряда острова начинается с ядра Po218(Be8-S46-Ne24-S46-Be8-S46-Be8-Ne24-Be8). Одна из линий ряда острова c N=P+52 начинается с ядра Rn224 (He4-Ar48-Mg30-Ar54-He4-Ar48-He4-Mg28-He4). Одна из линий ряда острова c N=P+54 начинается с ядра Rn226 (He4-Ar48-Mg30-Ar54-He4-Ar48-He4-Mg30-He4). Одна из линий ряда острова c N=P+56 начинается с ядра Rn228 (He4-Be8-S46-Be8-S46-Be8-S46-Be8-S46-Be8). Одна из линий ряда острова c N=P+58 начинается с ядра Th238(C12-Ar48-Mg30-Ar54-He4-Ar54-He4-Mg28-He4). Одна из линий ряда острова c N=P+60 начинается с ядра Cf256(C12-Ar48-Mg30-Ar54-Mg30-Ar48-Mg30-He4).
36 В данной модели химические свойства атома являются следствием пространственного внутреннего строения ядра атома. А любое ядро атома может находиться в нескольких изомерных состояниях, отличающихся друг от друга внутренним строением. Лишь некоторые атомы с ядрами в основном состоянии могут вступать в химические реакции без предварительного возбуждения. Абсолютное же большинство атомов с ядрами в основном состоянии являются химически инертными. Для того, чтобы такие атомы заставить вступить в химическую реакцию, необходимо каким-либо способом возбудить ядра этих атомов и перевести в одно из валентных изомерных состояний. Валентные изомерные состояния теоретически возможны для всех ядер. В настоящее время и экспериментально зафиксированы случаи редких химических реакций для атомов, долгое время считавшихся абсолютно инертными (Ar, Ne, He). В рамках данной модели даже существуют теоретические валентные состояния, которые еще не получены экспериментально. В разных условиях теоретически возможны разные долгоживущие изомерные состояния атомного ядра, что является причиной проявления разной валентности в разных химических соединениях. Так, у лития, кроме одновалентного состояния, должно существовать и трехвалентное изомерное плоское состояние 3Li7(7/2)(3xH2-n)(+3). У короткоживущего изотопа Be8 при отсутствии возбуждающих факторов может существовать стабильное изомерное двухвалентное состояние 4Be8(2)(He4-2xH2)(+2). Изотоп Be9 может иметь изомерное четырехвалентное плоское состояние 4Be9(9/2)(4xH2-n)(+4), два двухвалентных состояния 4Be9(5/2)(He4-2xH2-n)(+2), 4Be9(5/2)(1xH2-He4-1xH2-n)(+2), одновалентное состояние 4Be9(3/2)(He4-1xH2-H3b)(+1) и химически инертное плоское состояние 4Be9(1/2)(Be8-n)(0). Изотоп B10 может обладать двумя трехвалентными состояниями 5B10(3)(He4-3xH2)(+3), 5B10(3)(1xH2-He4-2xH2)(+3) и одним одновалентным состоянием 5B10(1)(He4-1xH2-He4)(+1). Изотоп B11 может обладать двумя трехвалентными состояниями 5B11(7/2)(He4-3xH2-n)(+3), 5B11(7/2)(1xH2-He4-2xH2-n)(+3), двухвалентным состоянием 5B11(5/2)(He4-2xH2-H3b)(+2), положительно одновалентным состоянием 5B11(3/2)(Be8-n-1xH2)(+1), плоским отрицательно одновалентным состоянием 5B11(5/2)(B11)(-1) и химически инертным состоянием 5B11(1/2)(Be8-H3b)(0). Для изотопа C12 теоретически возможны три четырехвалентных состояния 6С12(4)(He4-4xH2)(+4), 6С12(4)(2xH2-He4-2xH2)(+4), 6С12(4)(1xH2-He4-3xH2)(+4), положительно двухвалентное состояние 6С12(2)(He4-2xH2-He4)(+2) и два химически инертных состояния 6С12(0)(He4-Be8)(0) и плоский изомер 6С12(0)(С12)(0). Изотоп C13 может обладать тремя четырехвалентными состояниями 6С13(9/2)(He4-4xH2-n)(+4), 6С13(9/2)(2xH2-He4-2xH2-n)(+4), 6С13(9/2)(1xH2-He4-3xH2-n)(+4), трехвалентным состоянием 6C13(7/2)(He4-3xH2-H3b)(+3), двухвалентным состоянием 6С13(5/2)(Be8-n-2xH2)(+2) и двумя инертными состояниями 6С13(1/2)(He4-Be8-n)(0), 6С13(1/2)(С12-n)(0). Изотоп N14 может иметь два пятивалентных состояния 7N14(5)(1xH2-He4-4xH2)(+5), 7N14(5)(2xH2-He4-3xH2)(+5), трехвалентное состояние 7N14(3)(He4-3xH2-He4)(+3) и одновалентное состояние 7N14(1)(Be8-He4-1xH2)(+1). Изотоп N15 может иметь два пятивалентных состояния 7N15(11/2)(1xH2-He4-4xH2-n)(+5), 7N15(11/2)(2xH2-He4-3xH2-n)(+5), четырехвалентное состояние 7N15(9/2)(He4-4xH2-H3b)(+4), трехвалентное состояние 7N15(7/2)(Be8-n-3xH2)(+3), одновалентное состояние 7N15(3/2)(Be8-He4-1xH2-n)(+1) и инертное состояние 7N15(1/2)(He4-Be8-H3b)(0). Изотоп O16 может иметь два шестивалентных состояния 8O16(6)(2xH2-He4-4xH2)(+6), 8O16(6)(3xH2-He4-3xH2)(+6), четырехвалентное состояние 8O16(4)(He4-4xH2-He4)(+4), двухвалентное состояние 8O16(2)(Be8-He4-2xH2)(+2), состояние со смешанной валентностью 8O16(2)(He4-Be8w-He4)(+1,-2) и два инертных состояния 8O16(0)(He4-C12)(0), 8O16(0)(He4-Be8-He4)(0). Изотоп O17 может иметь два шестивалентных состояния 8O17(13/2)(2xH2-He4-4xH2-n)(+6), 8O17(13/2)(3xH2-He4-3xH2-n)(+6), пятивалентные состояния 8O17(11/2)(1xH2-He4-4xH2-H3b)(+5), 8O17(11/2)(2xH2-He4-3xH2-H3b)(+5), четырехвалентное состояние 8O17(9/2)(Be8-4xH2-n)(+4), три двухвалентных состояния 8O17(5/2)(Be8-He4-2xH2-n)(+2), 8O17(5/2)(He4-Be8-n-2xH2)(+2), 8O17(5/2)(1xH2-n-Be8-He4-1xH2)(+2), одновалентное состояние 8O17(3/2)(H3b-Be8-He4-1xH2)(+1) и инертное состояние 8O17(1/2)(He4-C12-n)(0). Изотоп O18 может иметь два шестивалентных состояния 8O18(7)(n-2xH2-He4-4xH2-n)(+6), 8O18(7)(n-3xH2-He4-3xH2-n)(+6), четырехвалентное состояние 8O18(5)(n-Be8-4xH2-n)(+4), три двухвалентных состояния 8O18(3)(n-Be8-He4-2xH2-n)(+2), 8O18(3)(He4-Be8-n-2xH2-n)(+2), 8O18(3)(1xH2-n-Be8-He4-1xH2-n)(+2), одновалентное состояние 8O18(2)(H3b-Be8-He4-1xH2-n)(+1), отрицательно двухвалентное состояние 8O18(0)(He4-Be10-He4)(-2), смешанное состояние 8O18(5)(He4-Be10-He4)(+1,-2) и инертное состояние 8O18(1)(H3b-С12-H3b)(0). Изотоп F19 может иметь трехвалентное состояние 9F19(7/2)(He4-Be8-n-3xH2)(+3), положительно одновалентное состояние 9F19(3/2)(He4-Be8-He4-1xH2-n)(+1), отрицательно одновалентное состояние 9F19(5/2)(He4-B11-He4)(-1) и инертное состояние 9F19(1/2)(He4-C12-H3b)(0). Изотоп Ne20 может иметь четырехвалентное состояние 10Ne20(4)(Be8-He4-4xH2)(+4), двухвалентное состояние 10Ne20(2)(С12-He4-2xH2)(+2) и два инертных состояния 10Ne20(0)(He4-C12-He4)(0), 10Ne20(0)(Be8-He4-Be8)(0). Изотоп Ne21 может иметь четырехвалентное состояние 10Ne21(9/2)(Be8-He4-4xH2-n)(+4), двухвалентное состояние 10Ne21(5/2)(С12-He4-2xH2-n)(+2), одновалентное состояние 10Ne21(3/2)(H3b-С12-He4-1xH2)(+1) и инертное состояние 10Ne21(1/2)(Be8-n-C12)(0). Изотоп Ne22 может иметь четырехвалентное состояние 10Ne22(5)(n-Be8-He4-4xH2-n)(+4), двухвалентное состояние 10Ne22(3)(n-С12-He4-2xH2-n)(+2), одновалентное состояние 10Ne22(2)(H3b-С12-He4-1xH2-n)(+1), отрицательно двухвалентное состояние 10Ne22(0)(Be8-He4-Be10)(-2), смешанное состояние 10Ne22(5)(Be8-He4-Be10)(+1,-2) и инертное состояние 10Ne22(1)(n-С12-n-Be8)(0).
37 Считается, что наиболее устойчивы ядра, у которых магическое число протонов (2, 8, 20, 28, 50, 82, 114) или нейтронов (2, 8, 20, 28, 50, 82, 126, 184). В таблице ниже от каждого химического элемента выбрано по одному изотопу с максимальной энергией связи. Судя по таблице, пиками удельной энергии связи обладают ядра 2He4(2p+2n), 4Be8(4p+4n), 8O16(8p+8n), 14 Si30(14p+16n), 16S34(16p+18n), 18Ar38(18p+20n), 22Ti50(22p+28n), 24Cr54(24p+30n), 26Fe58(26p+32n), 28Ni62(28p+34n), 30Zn66(30p+36n), 32Ge72(32p+40n), 34Se78(34p+44n), 36Kr84(36p+48n), 38Sr88(38p+50n), у которых число протонов равно 2, 4, 8, 14, 16, 18, 22, 24, 26, 28, 30, 32, 34, 36, 38, а число нейтронов равно 2, 4, 8, 16, 18, 20, 28, 30, 32, 34, 36, 40, 44, 48, 50. Из них сверхпиками удельной энергии связи обладают ядра 2He4(2p+2n), 28Ni62(28p+34n), 38Sr88(38p+50n). Существование более половины магических чисел не подтверждается экспериментальными данными.
Список изотопов с пиками энергии связи, КэВ
|
1H3 2827 |
2He4 7074 |
3Li7 5606 |
4Be8 7062 |
5B11 6927 |
6C12 7680 |
7N15 7699 |
8O16 7976 |
9F19 7779 |
10Ne22 8080 |
|
11Na23 8111 |
12Mg26 8334 |
13Al29 8349 |
14Si30 8521 |
15P33 8514 |
16S34 8584 |
17Cl37 8570 |
18Ar38 8614 |
19K43 8577 |
20Ca46 8669 |
|
21Sc49 8686 |
22Ti50 8756 |
23V51 8742 |
24Cr54 8778 |
25Mn55 8765 |
26Fe58 8792 |
27Co59 8768 |
28Ni62 8795 |
29Cu65 8757 |
30Zn66 8760 |
|
31Ga69 8725 |
32Ge72 8732 |
33As75 8701 |
34Se78 8718 |
35Br81 8696 |
36Kr84 8717 |
37Rb87 8711 |
38Sr88 8733 |
39Y89 8714 |
40Zr90 8710 |
|
41Nb91 8671 |
42Mo94 8662 |
43Tc97 8624 |
44Ru98 8620 |
45Rh101 8588 |
46Pd104 8585 |
47Ag107 8554 |
48Cd110 8551 |
49In113 8523 |
50Sn116 8523 |
|
51Sb117 8488 |
52Te122 8478 |
53I125 8450 |
54Xe126 8444 |
55Cs133 8410 |
56Ba132 8409 |
57La135 8383 |
58Ce140 8376 |
59Pr141 8354 |
60Nd142 8346 |
|
61Pm143 8318 |
62Sm144 8304 |
63Eu147 8264 |
64Gd146 8250 |
65Tb149 8210 |
66Dy154 8193 |
67Ho159 8165 |
68Er162 8152 |
69Tm165 8126 |
70Yb168 8112 |
|
71Lu169 8086 |
72Hf172 8072 |
73Ta175 8044 |
74W176 8030 |
75Re181 8004 |
76Os180 7987 |
77Ir185 7964 |
78Pt186 7947 |
79Au193 7924 |
80Hg194 7915 |
|
81Ti197 7894 |
82Pb202 7882 |
83Bi203 7858 |
84Po206 7841 |
85At209 7815 |
86Rn210 7797 |
87Fr213 7768 |
88Ra214 7749 |
89Ac215 7720 |
90Th216 7698 |
|
91Pa217 7665 |
92U218 7641 |
93Np225 7608 |
94Pu230 7591 |
95Am233 7567 |
96Cm234 7551 |
97Bk239 7527 |
98Cf240 7510 |
99Es243 7486 |
Fm246 7468 |
|
Md247 7444 |
No250 7426 |
Lr255 7402 |
Rf256 7385 |
Db257 7361 |
Sg260 7342 |
Bh263 7317 |
Hs264 7298 |
Mt267 7273 |
Ds272 7254 |
|
Rg273 7229 |
Uub278 7206 |
Uut283 7178 |
Uug286 7161 |
Uup291 7140 |
|
|
|
|
|
Ядра атомов с p=20 не имеют пика удельной энергии связи. Скорее всего, вывод о магическом свойстве данного количества протонов основан на другом явлении – у кальция особо большое количество стабильных изотопов. Но это всего лишь случайное стечение обстоятельств. Стабильных изотопов у кальция – 6 штук, у соседнего титана – 5 штук. На изотопах 20Ca46, 20Ca48 произошел случайный скачок стабильности в начале рядов n=p+6, n=p+8. Для этих изотопов наиболее подходящими изомерами являются 20Ca46(Be8-n-Mg28-n-Be8), 20Ca48(n-Be8-n-Mg28-n-Be8-n). По соотношению геометрических размеров изомеры не должны быть стабильными. Скачок стабильности произошел по причине дополнительного слипания всех трех слоев кольцами из 4 нейтронов. Крепкие связи надежно скрепляют ядра и не дают перейти в другое изомерное состояние при внешнем возбуждении. Стабильных ядер атомов с n=20 – 5 штук. А в соседних ядрах с n=18 и n=22 только по три стабильных ядра. Но это опять случайность, которая возникла по причине того, что изотоп 20Ca40 является последним стабильным изотопом в ряду n=p, а изотоп 16S36 является первым стабильным в ряду n=p+4. . Стабильных ядер атомов с n=28 – 5 штук, с n=30 – 4 штуки. С учетом того, что скачок стабильности изотопа 20Ca48 уже объяснен, то ряд n=28 ничем особенным больше не выделяется. Стабильных ядер атомов с p=28 – 5 штук, столько же в соседнем ряду с p=30. При этом, здесь на изотопе Ni58 кончается стабильный ряд с n=p+2, а с изотопа Ni64 начинается стабильный ряд с n=p+8. Стабильных ядер атомов с p=48 – 8 штук, с p=50 – 10 штук, с p=52 – 8 штук. Опять случайно у элемента Sn(p=50) больше стабильных изотопов. Изотоп Sn112 является последним стабильным в ряду n=p+12. С другой стороны начинаются первые стабильные изотопы Sn122(He4-Be8-Ne24-Sn46-Ne24-Be8), Sn124(He4-Be8-n-Ne24-Sn46-Ne24-n-Be8) в рядах n=p+22, n=p+24. Скачок стабильности здесь произошел по причине дополнительного слипания пяти ядерных слоев кольцами из 4 нейтронов. Стабильных ядер атомов с n=50 не больше, чем в соседнем ряду n=48. Стабильных изотопов у Pb(p=82) даже меньше, чем у соседнего Hg(p=80). В ряду n=82 явно завышенной стабильностью обладает изотоп Xe136. Этот скачок стабильности можно объяснить дополнительным слипанием семи ядерных слоев кольцами из 4 нейтронов в изомере 54Xe136(He4-Be8-Ne24-Be8-n-S46-n-Be8-Ne24-Be8-He4). Стабильных ядер атомов с n=126 не больше, чем в соседнем ряду n=124. Единственной особенностью этого ряда является то, что в нем находится самый тяжелый стабильный изотоп Bi209. Значения p=114 и n=184 магическими считаются теоретически. Экспериментальных данных нет.
38 Экспериментальные данные приводятся для энергии связи ядер атомов в основном состоянии. Вывод точной формулы для расчета энергии связи ядра затруднен в связи с проблемой идентификации конфигурации основного состояния. Например, для ядра Ne20 экспериментальное значение энергии связи составляет 160644,8 КэВ. Экспериментальным значениям других параметров соответствуют сразу две конфигурации: (He4-C12-He4) и (Be8-He4-Be8). Остается только гадать, у какого изомера экспериментаторы измеряли энергию связи. При условии точной идентификации можно было бы вывести новую полуэмпирическую формулу, которая была бы гораздо точнее формулы Вейцзеккера. Формула должна состоять из нескольких слагаемых. Первый член формулы есть сумма нескольких членов, которую обозначим следующим образом: (k1*a1+k2*a2+…), где a1, a2, a3…- энергии связи ядерных слоев He4, Be8, C12…, а коэффициенты k1, k2, k3… - соответствующие количества таких оболочек в ядре. Для конфигурации (He4-C12-He4) вид суммы – 2* a(He4)+ 1*a(C12), а для конфигурации (Be8-He4-Be8) совсем другой вид суммы – 1* a(He4)+ 2*a(Be8). Второй член формулы должен учитывать притяжение между соседними слоями. Его также можно представить в виде суммы нескольких членов: (n1*b1+n2*b2+…). В ядрах Ne20 притяжения между слоями нет, эти члены нулевые. А вот в конфигурации Ar40(Be8-Ne24-Be8) соседние слои дополнительно притягиваются друг к другу кольцами из 4 нейтронов, здесь второй член формулы будет выглядеть так: 2*b(Be8-Ne24). Третий член формулы отрицательный и должен учитывать кулоновское отталкивание между одинаковыми слоями. В общем виде его также можно представить в виде суммы нескольких членов: (-m1*c1-m2*c2-…). Для конфигурации (He4-C12-He4) вид третьего члена – -2*c(He4-He4), а для конфигурации (Be8-He4-Be8) совсем другой вид – -2*с(Be8-Be8). Нейтроны слоя C12 полностью изолируют кулоновское отталкивание слоев He4-He4, поэтому третий член в этом случае должен быть нулевым. А вот возможности полной изоляции друг от друга слоев Be8-Be8 сомнительны. В данном случае между протонами находятся не нейтроны, а электронные лепестки, плотность которых гораздо меньше. Максимального значения третий член достигает при полном отсутствии каких-либо изолирующих слоев (конфигурация Be8(He4-He4) разваливается на части). Четвертый член формулы отрицательный и должен учитывать степень вытянутости ядра – чем больше вытянуто ядро, тем больше его объем, тем меньше разность давлений эфира, тем меньше энергия связи. Геометрические размеры конфигурации (He4-C12-He4) – 4х5 нуклонов, геометрические размеры конфигурации (Be8-He4-Be8) – 3х4,5 нуклона. Первая конфигурация ближе к сфере, поэтому для нее меньше уменьшается энергия связи. Пятый член формулы отрицательный и должен учитывать степень гладкости поверхности ядра – чем глаже поверхность, тем меньше объем ядра, тем больше разность давлений эфира, тем больше энергия связи. Например, поверхность изомера (He4-Be8-C12-Be8-He4) имеет более гладкую поверхность, чем поверхность изомера (Be8- He4-C12-He4-Be8).
39 Так как еще не было деления химических элементов на изотопы, то первоначально таблица Менделеева была составлена для наиболее распространенных в природе изотопов и фиксировала она периодичность химических свойств именно этих изотопов. В этом представлении первый период заканчивается изотопом He4, а второй период заканчивается изотопом Ne20. Периодичность химических свойств химических элементов второго периода можно объяснить последовательным заполнением в ядрах атомов двух новых оболочек C12 и He4. Тогда, для наиболее распространенных химически связанных атомов, последовательность заполнения ядерных оболочек можно представить следующим образом: 2He4(0), 3Li7(3/2)(He4-1xH2-n)(+1), 4Be9(5/2)(He4-2xH2-n)(+2), 5B11(7/2)(He4-3xH2-n)(+3), 6С12(4)(He4-4xH2)(+4), 7N14(3)(He4-3xH2-He4)(+3,-3), 8O16(2)(He4-Be8w-He4)(+1,-2), 9F19(5/2)(He4-B11-He4)(-1), 10Ne20(0)(He4-C12-He4)(0). При таком представлении валентность химических элементов в ряду последовательно растет от 1 до 4, затем последовательно убывает до 0. Изомеры неона (He4-C12-He4), (Be8-He4-Be8) в качестве инертной части полностью входят в состав ядер атомов третьего периода. Периодичность химических свойств химических элементов третьего периода можно объяснить последовательным заполнением в ядрах атомов двух новых оболочек C12 и He4: 11Na23(3/2)(Be8-He4-Be8-n-1xH2)(+1), 12Mg24(2)(He4-C12-He4-2xH2)(+2), 13Al27(7/2)(Be8-He4-Be8-n-3xH2)(+3), 14Si28(4)(He4-C12-He4-4xH2)(+4), 15P31(7/2)(Be8-He4-Be8-n-3xH2-He4)(+3,-3), 16S32(2)(He4-C12-He4-Be8w-He4)(+1,-2), 17Cl35(5/2)(He4-C12-He4-B11-He4)(-1), 18Ar36(0)(He4-C12-He4-C12-He4)(0).
40 Логично предположить, что в четвертом периоде должны последовательно заполняться в ядрах атомов еще две новые оболочки C12 и He4. При этом, в состав ядер в качестве инертной части должны входить изомеры аргона (He4-C12-He4-C12-He4), (C12-He4-Be8-He4-Be8). Составим такой ряд: 19K39(3/2)(He4-C12-He4-C12-He4-1xH2-n)(+1), 20Ca40(2)(He4-C12-He4-C12-He4-2xH2)(+2), 21Sc43(7/2)(He4-C12-He4-C12-He4-3xH2-n)(+3), 22Ti44(4)(He4-C12-He4-C12-He4-4xH2)(+4), 23V47(7/2)(He4-C12-He4-Be8-He4-Be8-n-3xH2)(+3,-3), 24Cr48(2)(He4-C12-He4-C12-He4-Be8w-He4)(+1,-2), 25Mn51(5/2)(He4-C12-He4-C12-He4-B11-He4)(-1), 26Fe52(0)(He4-C12-He4-C12-He4-C12-He4)(0). Однако из этого ряда только первые два изотопа являются наиболее распространенными. Они являются полными аналогами элементов первого и второго ряда второго и третьего периода. Вероятность существования остальных членов резко уменьшается по причине удлинения до 8 нуклонных слоев одного из ядерных изомеров. Наиболее вероятно же образование изомеров с ядром, близким к форме сферы, где диаметр ядра равен диаметру слоя C12 (5 нуклонов), а высота ядра лежит в пределах 4-6 нуклонов. В отличие от второго и третьего периода четвертый период является совокупностью нескольких одновременно существующих периодических рядов. Основателем второго ряда является 18Ar38(1)(He4-Be8-n-C12-n-Be8-He4)(0), концом является 26Fe54(1)(He4-Be8-n-C12-n-Be8-He4-C12-He4)(0). Основателем третьего ряда является 18Ar40(0)(Be8-Ne24-Be8)(0), конец ряда: 26Fe56(0)(Be8-Ne24-Be8-He4-C12)(0). Основатель четвертого ряда: 20Ca44(0)(Be8-Mg28-Be8)(0), конец ряда: 28Ni60(0)(Be8-Mg28-Be8-He4-C12)(0). Основатель пятого ряда: 20Ca48(1)(Be8-n-Mg30-n-Be8)(0), конец ряда: 28Ni64(1)(Be8-n-Mg30-n-Be8-He4-C12)(0). Изотоп 28Ni60(0)(C12-He4-Be8-Mg28-Be8) является основателем первого ряда второго полупериода четвертого периода таблицы Менделеева, конец ряда: 36Kr76(0)(C12-He4-Be8-Mg28-Be8-He4-C12). Основатель второго ряда второго полупериода: 28Ni62(0)(He4-C12-Mg30-С12-He4)(0), конец ряда 36Kr78(0)(He4-C12-Mg30-С12-He4-C12-He4)(0). Здесь диаметр ядра составляет 7 нуклонов (Mg30), следовательно, высота наиболее вероятных ядер ряда должна лежать в пределах 6-8 нуклонов. Основатель третьего ряда второго полупериода четвертого периода: 28Ni64(0)(Mg28-Be8-Mg28)(0). Основатель четвертого ряда: 28Ni66(0)(He4-Mg28-He4-Mg30)(0). Основатель пятого ряда: 28Ni68(0)(He4-Mg30-He4-Mg30)(0). Основатель шестого ряда: 28Ni70(1)(Mg30-n-Be8-n-Mg30)(0). Химические элементы K и Ca сильно отличаются степенью химической активности от элементов Cu и Zn. Это означает, что для изотопов K и Ca наиболее вероятны валентные состояния, а для изотопов Cu и Zn наиболее вероятны инертные состояния. Примеры: 29Cu63(1/2)(H3b-C12-He4-Be8-Mg28-Be8)(0), 30Zn64(0)(He4-C12-He4-Be8-Mg28-Be8)(0), 29Cu65(1/2)(H3b-C12-He4-Mg30-He4-С12)(0), 30Zn66(0)(He4-C12-He4-Mg30-He4-С12)(0), 29Cu67(1/2)(H3b-Mg28-Be8-Mg28)(0), 30Zn68(0) (He4-Mg28-Be8-Mg28)(0).
41 Пятый период также является совокупностью нескольких одновременно существующих периодических рядов. Основатель первого ряда, включающего стабильные изотопы: 36Kr82(0)(He4-Mg28-He4-Mg30-C12-He4)(0). Основатель второго ряда: 36Kr84(0)(He4-Mg30-He4-Mg30-C12-He4)(0) или 36Kr84(0)(He4-C12-He4-Ar48-C12-He4)(0). В последнем изомере диаметр ядра составляет 9 нуклонов (Ar48), следовательно, высота наиболее вероятных ядер ряда должна лежать уже в пределах 8-10 нуклонов. Основатель первого ряда второго полупериода: 46Pd104(He4-Mg28-Be8-Mg28-Be8-Mg28). Основатель второго ряда: 46Pd106(Be8-Mg28-Be8-Mg28-He4-Mg30). Основатель третьего ряда: 46Pd108(He4-Mg28-He4-Mg30-C12-Mg30). Основатель четвертого ряда: 46Pd110(He4-Mg30-He4-Mg30-C12-Mg30). Основатель пятого ряда: 46Pd112(Mg28-He4-Ar48-He4-Mg28). Основатель шестого ряда: 46Pd114(Mg30-He4-Ar48-He4-Mg28). Основатель седьмого ряда: 46Pd116(Mg30-He4-Ar48-He4-Mg30). Основатель восьмого ряда: 46Pd118(Mg28-He4-Ar54-He4-Mg28). Химические элементы Rb и Sr сильно отличаются степенью химической активности от элементов Ag и Cd. Это означает, что для изотопов Rb и Sr наиболее вероятны валентные состояния, а для изотопов Ag и Cd наиболее вероятны инертные состояния. Примеры: 47Ag107(1/2)(He4-Mg28-Be8-Mg28-Be8-Mg28-H3b)(0), 48Cd108(0)(He4-Mg28-Be8-Mg28-Be8-Mg28-He4)(0), 47Ag109(1/2)(Be8-Mg28-Be8-Mg28-He4-Mg30-H3b)(0), 48Cd110(0)(Be8-Mg28-Be8-Mg28-He4-Mg30-He4)(0).
42 Шестой период также является совокупностью нескольких одновременно существующих периодических рядов. Основатель первого ряда, включающего стабильные изотопы: 54Xe126(Mg30-C12-Mg30-C12-Mg30-C12). Основатель второго ряда: 54Xe128(Be8-Mg28-He4-Ar48-He4-Mg28-Be8). Основатель третьего ряда: 54Xe130(He4-C12-Mg30-Ar48-He4-Mg28-He4). Основатель четвертого ряда: 54Xe132(C12-Mg30-Ar48-Mg30-С12). Основатель пятого ряда: 54Xe132(C12-Mg30-n-Ar48-n-Mg30-С12). Основатель первого ряда второго полупериода: 78Pt192(C12-Mg30-Ar48-С12-Ar48-Mg30-C12). Основатель второго ряда: 78Pt194(C12-Mg30-n-Ar48-С12-Ar48-n-Mg30-C12). Основатель третьего ряда: 78Pt196(C12-Mg30-n-Ar48-n-С12-n-Ar48-n-Mg30-C12) или 78Pt196(He4-Mg30-Ar48-He4-Ne24-He4-Ar48-Mg30-He4). Основатель четвертого ряда: 78Pt198(He4-Mg30-Ar48-He4-Mg30 -Ar48-Mg30-He4). Основатель пятого ряда: 78Pt200(He4-Mg30-Ar48-He4-Mg30-n-Ar48-n-Mg30-He4). Химические элементы Cs и Ba сильно отличаются степенью химической активности от элементов Au и Hg. Это означает, что для изотопов Cs и Ba наиболее вероятны валентные состояния, а для изотопов Au и Hg наиболее вероятны инертные состояния. Примеры: 79Au197(C12-Mg30-n-Ar48-С12-Ar48-n-Mg30-C12-H3b), 80Hg198(C12-Mg30-n-Ar48-С12-Ar48-n-Mg30-C12-He4) – для данной инертной части (78Pt194) валентное состояние Au и Hg вообще невозможно.
43 В седьмом периоде всего только четыре стабильных изотопа. Тем не менее, принципы конфигурации ядер атомов данного периода аналогичны, если рассматривать не только стабильные изотопы, но и долгоживущие. Седьмой период также является совокупностью нескольких одновременно существующих периодических рядов. Основателем первого ряда долгоживущих изотопов является 86Rn222(Ar48-He4-Mg28-He4-Ar54-He4-Mg28-He4-Ar48), членом этого ряда является стабильный изотоп 92U234. Основатель второго ряда: 86Rn224(He4-Ar48-Mg30-Ar54-He4-Mg28-He4-Ar48-He4), членом этого ряда является стабильный изотоп 90Th232. Основатель третьего ряда: 86Rn226(С12-Ar48-Mg30-Ar54-Mg30-Ar48-He4), членом этого ряда является стабильный изотоп 92U238.
44 По аналогии с предыдущими рядами, основателем самых последних периодических рядов в седьмом ряду должен быть химический элемент 110Ds. Для этого элемента самыми крепкими будут следующие конфигурации: 110Ds280(He4-С12-Mg30-Ar48-Mg30-Ar48-Mg30-Ar48-Mg30), 110Ds282(He4-С12-Mg30-Ar48-Mg30-n-Ar48-n-Mg30-Ar48-Mg30), 110Ds284(He4-С12-Mg30-Ar48-n-Mg30-n-Ar48-n-Mg30-n-Ar48-Mg30), 110Ds286(He4-С12-Mg30-n-Ar48-n-Mg30-n-Ar48-n-Mg30-n-Ar48-n-Mg30), 110Ds286(He4-С12-Mg30-Ar48-Mg30-Ar54-Mg30-Ar48-Mg30), 110Ds288(He4-С12-Mg30-Ar48-Mg30-n-Ar54-n-Mg30-Ar48-Mg30), 110Ds290(He4-С12-Mg30-Ar48-n-Mg30-n-Ar54-n-Mg30-n-Ar48-Mg30), 110Ds292 (He4-С12-Mg30-n-Ar48-n-Mg30-n-Ar54-n-Mg30-n-Ar48-n-Mg30), 110Ds292(He4-С12-Mg30-Ar54-Mg30-Ar48-Mg30-Ar54-Mg30), 110Ds294(He4-С12-Mg30-n-Ar54-n-Mg30-Ar48-Mg30-Ar54-Mg30), 110Ds296(He4-С12-Mg30-n-Ar54-n-Mg30-Ar48-Mg30-n-Ar54-n-Mg30), 110Ds298(He4-С12-Mg30-n-Ar54-n-Mg30-n-Ar48-n-Mg30-n-Ar54-n-Mg30), 110Ds298(He4-С12-Mg30-Ar54-Mg30-Ar54-Mg30-Ar54-Mg30), 110Ds300(He4-С12-Mg30-Ar54-Mg30-n-Ar54-n-Mg30-Ar54-Mg30), 110Ds302(He4-С12-Mg30-Ar54-n-Mg30-n-Ar54-n-Mg30-n-Ar54-Mg30), 110Ds304(He4-С12-Mg30-n-Ar54-n-Mg30-n-Ar54-n-Mg30-n-Ar54-n-Mg30), 110Ds306(He4-С12-n-Mg30-n-Ar54-n-Mg30-n-Ar54-n-Mg30-n-Ar54-n-Mg30-n). В этих конфигурациях соседние слои С12, Ar54, Mg30, Ar48 крепко скреплены друг с другом нейтронными кольцами. Такие ядра развалятся только в том случае, если в результате внешнего воздействия перейдут в другое, менее устойчивое изомерное состояние. Диаметр таких ядер равен 9 нуклонам. Соответственно, высота самых стабильных ядер должна быть в пределах 8-10 нуклонов. Под эти параметры подпадают и перечисленные изомеры, и первые элементы рожденных ими периодических рядов, которые заканчиваются следующими изомерами: 118/296(He4-С12-Mg30-Ar48-Mg30-Ar48-Mg30-Ar48-Mg30-С12-He4), 118/302(He4-С12-Mg30-Ar48-Mg30-Ar54-Mg30-Ar48-Mg30-С12-He4), 118/308(He4-С12-Mg30-Ar54-Mg30-Ar48-Mg30-Ar54-Mg30-С12-He4), 118/314(He4-С12-Mg30-Ar54-Mg30-Ar54-Mg30-Ar54-Mg30-С12-He4). Под параметры стабильности подпадают и члены предыдущих периодических рядов, которые заканчиваются изотопами элемента 110Ds. Основателями этих рядов будут изотопы 102No264(Mg30-Ar48-Mg30-Ar48-Mg30-Ar48-Mg30), 102No270(Mg30-Ar48-Mg30-Ar54-Mg30-Ar48-Mg30), 102No276(Mg30-Ar54-Mg30-Ar48-Mg30-Ar54-Mg30), 102No282(Mg30-Ar54-Mg30-Ar54-Mg30-Ar54-Mg30). Небольшая модификация конфигурации (Mg30-Ar48-Mg30-Ar48-Mg30-Ar48-Mg30) в конфигурацию (Ar48-Mg30-Ar48-Mg30-Ar48-Mg30-Ar48) не изменяет высоты ядра. Следовательно, на основе новой более тяжелой конфигурации можно указать еще две области периодических рядов. Основатели первых рядов: 108Hs282(Ar48-Mg30-Ar48-Mg30-Ar48-Mg30-Ar48), 108Hs288(Ar48-Mg30-Ar54-Mg30-Ar48-Mg30-Ar48), 108Hs294(Ar48-Mg30-Ar54-Mg30-Ar54-Mg30-Ar48), 108Hs300(Ar48-Mg30-Ar54-Mg30-Ar54-Mg30-Ar54), 108Hs306(Ar54-Mg30-Ar54-Mg30-Ar54-Mg30-Ar54). Основатели вторых рядов: 116/298(He4-С12-Ar48-Mg30-Ar48-Mg30-Ar48-Mg30-Ar48), 116/304(He4-С12-Ar48-Mg30-Ar54-Mg30-Ar48-Mg30-Ar48), 116/310(He4-С12-Ar48-Mg30-Ar54-Mg30-Ar54-Mg30-Ar48), 116/316(He4-С12-Ar48-Mg30-Ar54-Mg30-Ar54-Mg30-Ar54), 116/322(He4-С12-Ar54-Mg30-Ar54-Mg30-Ar54-Mg30-Ar54). Конец вторых рядов: 124/314(He4-С12-Ar48-Mg30-Ar48-Mg30-Ar48-Mg30-Ar48-С12-He4), 124/320(He4-С12-Ar48-Mg30-Ar54-Mg30-Ar48-Mg30-Ar48-С12-He4), 124/326(He4-С12-Ar48-Mg30-Ar54-Mg30-Ar54-Mg30-Ar48-С12-He4), 124/332(He4-С12-Ar48-Mg30-Ar54-Mg30-Ar54-Mg30-Ar54-С12-He4), 124/338(He4-С12-Ar54-Mg30-Ar54-Mg30-Ar54-Mg30-Ar54-С12-He4).
Литература
- Асанбаева Дж.А. Решеточная модель ядра и атома. Бишкек: Технология, 2000, 76 с.
- Бердинских В.В. Популярные основы единых физических представлений. Часть 1. Физика глазами гидравлика. 1999
- Грызинский М. Атом водорода - электрон на радиальной орбите свободного падения. 2003 г.
- Грызинский М. Атом гелия – два вращающихся электрона в кулоновском поле ядра. 2003 г.
- Грызинский М. Многоэл. атомы. Радиальная кинетика – угловая симметрия – коллективное движение, 2003 г.
- Зоммерфельд А. Строение атомов и спектры. Т.1-М: Гостехиздат, 1956
- Сухоруков Г.И., Сухоруков Э.Г., Сухоруков Р.Г. Новая теория строения атомов. Братск.
Владимир Яковлев, lun1@list.ru , http://logicphysic.narod.ru , март 2011 года